技术摘要:
本申请涉及微流控技术领域,公开了一种微流控流道、电泳芯片、电泳分离检测系统及使用方法,目的是改善对样本混合物的电泳分离效果和分离效率。其中,微流控流道包括:流道主体,呈平面螺旋型结构,具有位于所述螺旋型结构内圈的进液端和位于所述螺旋型结构外圈的出液 全部
背景技术:
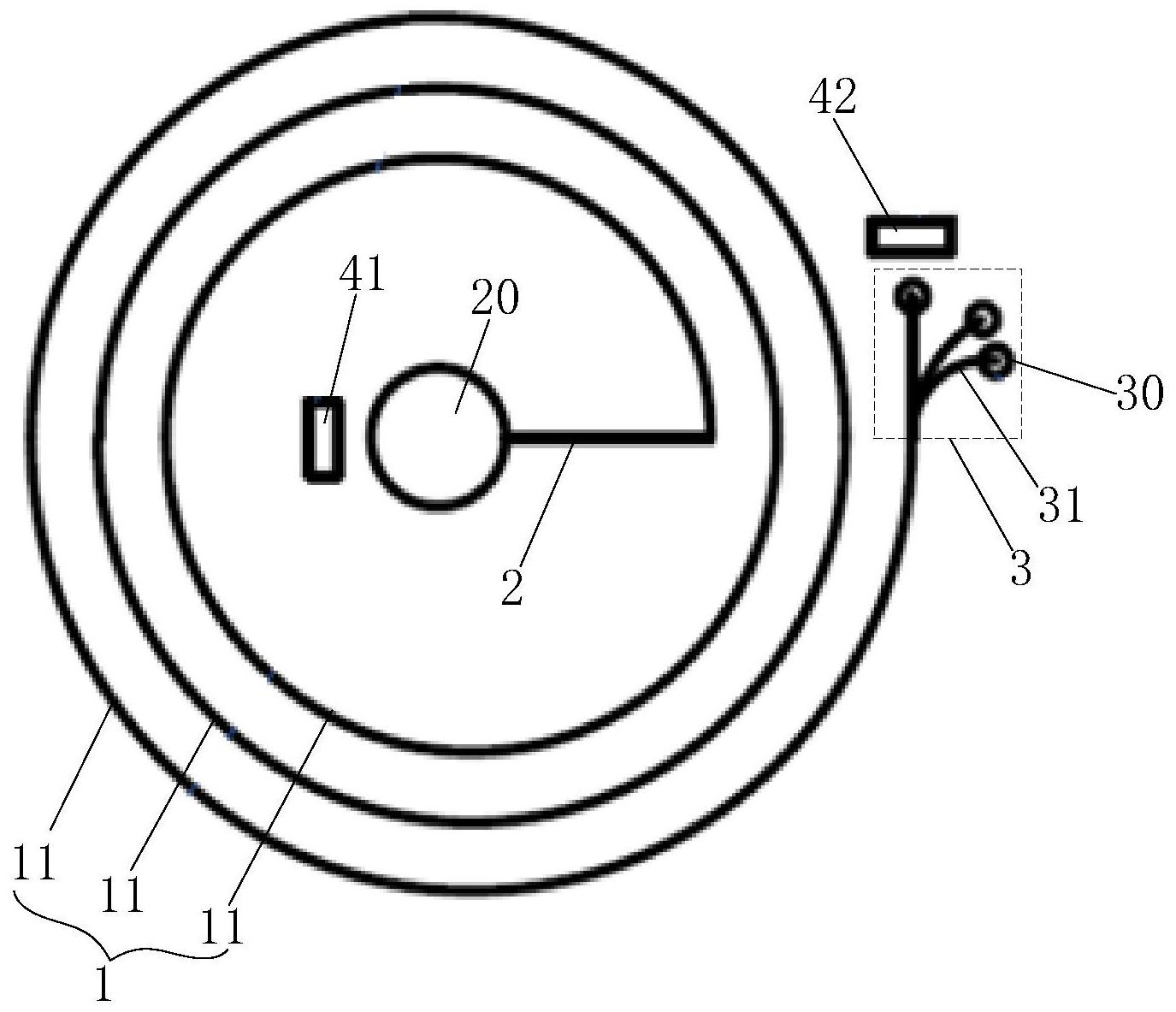
微流控芯片这一名词最初源于20世纪90年代Manz与Widmer提出微全分析系统(μ TAS)。Manz教授成功的把MEMS技术运用到分析化学领域,并在不久后在微芯片上实现了高 速毛细管电泳,成果发表在《Science》等杂志上,从此这一领域迅速受到学界重视,并成为 当今世界上最前沿的科技领域之一。芯片实验室(Lab on a chip)和微流控芯片 (Microfluidic Chip)都是人们对这一领域提出的不同名称,而随着这一学科的应用从最 初的分析化学拓展到多个研究与应用领域,以及研究者对这一学科的深入理解,微流控芯 片已经成为对这一领域的统称。 等速电泳(Isotachophoresis)属于毛细管电泳类型之一,通常用于生物样本中蛋 白质、核酸等物质的分离。其原理是根据样本内各组分在毛细管流路中的淌度不同而逐渐 形成各自独立的电泳区带,并在区带内富集聚焦,直至依次流出流路另一端,从而实现分 离。目前已有基于玻璃基的微流控芯片实现芯片上等速电泳分离的文献报道。但是一般的 等速电泳分离只能获得淌度相近的样本组分混合物,分离程度不高,通常需要接续其他方 法进行辅助分离,流程较长,操作不便且徒增分离成本。 申请内容 本申请公开了一种微流控流道、电泳芯片、电泳分离检测系统及使用方法,目的是 改善对样本混合物的电泳分离效果和分离效率。 一种微流控流道,包括: 流道主体,呈平面螺旋型结构,具有位于所述螺旋型结构内圈的进液端和位于所 述螺旋型结构外圈的出液端; 进液流段,与所述流道主体的进液端相连; 出液流段,包括至少两个分支流路,每个所述分支流路的一端分别与所述流道主 体的出液端相连,所述至少两个分支流路的与所述出液端相连的一端沿所述流道主体的内 圈至外圈的方向上依次排列。 本申请实施例提供的微流控流道,将流道主体设计为平面螺旋型结构,且进液端 位于内圈,出液端位于外圈,当液体从进液端进入后,在从内圈向外圈逐圈流动时,液体内 不同质量的物质粒子会在离心力的作用下发生分离,具体将沿内圈至外圈方向上(各圈流 道的宽度方向上)逐渐形成各自独立的流淌区带,进而,在最终到达出液端时,液体内不同 质量的物质粒子将分别进入出液流段的不同分支流路,进而从不同分支流路流出,从而可 以实现对液体中不同质量的组分进行分离。具体的,当将该微流控流道应用于等速电泳分 离技术时,该微流控流道的离心分离技术效果与等速电泳分离技术效果相结合,可以通过 一次性操作有效提高样本组分混合物的分离程度,无需接续其他辅助分离技术,可以简化 3 CN 111589479 A 说 明 书 2/6 页 流程,降低分离成本。 可选的,所述的微流控流道,还包括一对电泳电极,所述一对电泳电极中的两种电 极分别设置在所述至少两个分支流路的出口以及所述进液流段的进口处。 可选的,所述进液流段位于所述流道主体的内侧,所述进液流段的进口位于所述 螺旋型结构的中心。 可选的,所述流道主体的螺旋型结构包括3-6圈流道。 可选的,所述出液流段包括3-8个分支流路。 可选的,所述流道主体的各圈流道呈扁平状,所述各圈流道的宽度与深度的尺寸 比例为8-15。 可选的,所述各圈流道的宽度为1mm-2mm,所述各圈流道的深度为0.1mm-0.2mm。 可选的,所述流道主体的相邻圈流道之间的间隔为3mm-7mm。 可选的,所述进液流段的进口的直径为7mm-13mm,每个所述分支流路的出口的直 径为1.4mm-2.6mm。 一种电泳芯片,包括芯片本体,所述芯片本体具有如上述任一项所述的微流控流 道。 一种电泳分离检测系统,包括荧光显微装置,以及如上述的电泳芯片;所述荧光显 微装置用于对所述微流控流道中流出的荧光信号进行检测读取。 一种电泳分离检测系统的使用方法,包括: 对样本溶液进行荧光标记; 向如上述任一项所述的微流控流道中依次通入前导电解质、被荧光标记的样本溶 液,以及尾随电解质; 向微流控流道两端的一对电泳电极施加电压,以开始进行等速电泳分离; 通过荧光显微装置对所述至少两个分支流路的出口处的荧光信号进行检测读取。 附图说明 图1为等速电泳分离技术的原理示意图; 图2为本申请一实施例提供的一种微流控流道的结构示意图; 图3为本申请一实施例提供的一种电泳芯片的结构示意图; 图4为图3中的电泳芯片沿微流控流道的流道延伸方向上的截面结构示意图; 图5为本申请实施例提供的一种电泳分离检测系统的结构框图; 图6为本申请实施例提供的一种电泳分离检测系统的使用方法流程图。
技术实现要素:
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完 整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于 本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他 实施例,都属于本申请保护的范围。 具体的,本申请提供的微流控流道可以应用于微流控芯片中,具体可以用于电泳 分离芯片,例如,等速电泳芯片。 4 CN 111589479 A 说 明 书 3/6 页 等速电泳(Isotachophoresis)属于毛细管电泳类型之一,通常用于生物样本中蛋 白质、核酸等物质的分离。 等速电泳分离的一般操作流程如下:在毛细管流路中将两种电泳淌度差别较大的 离子缓冲液分别作为前导电解质(LE)和尾随电解质(TE) ,并使样本中的待分离物质的电泳 淌度介于LE和TE之间,如图1所示,其中,三角形粒子代表LE,六边形粒子代表TE,六角星粒 子代表样本中各组分,t0表示未加电场的初始时刻;具体的,在毛细管流路两端施加均匀强 电场之后,LE、样本物质、TE同时从电极一侧向另一侧移动,由于淌度差异,LE移动较快,样 本次之,TE最慢,行进过程中样本物质位于LE、TE之间,样本内各组分根据淌度不同逐渐形 成各自独立的电泳区带,并在区带内富集聚焦(如图1中的t1时刻所示),直至依次流出流路 另一端,从而实现分离。然而,此种等速电泳分离一般只能获得淌度相近的样本组分混合 物,分离程度不高,通常还需要接续其他方法进行辅助分离,流程较长,操作不便且徒增分 离成本。 鉴于此,本申请实施例提供一种微流控流道、电泳芯片、电泳分离检测系统及使用 方法,用以改善对样本混合物的电泳分离效果和分离效率。 如图2和图3所示,本申请实施例提供一种微流控流道,包括: 流道主体1,呈平面螺旋型结构,具有位于所述螺旋型结构内圈的进液端和位于所 述螺旋型结构外圈的出液端; 进液流段2,与所述流道主体1的进液端相连; 出液流段3,包括至少两个分支流路31,每个所述分支流路31的一端分别与所述流 道主体1的出液端相连,所述至少两个分支流路31的与所述出液端相连的一端沿所述流道 主体1的内圈至外圈的方向上依次排列。 参考图2所示,本申请实施例提供的微流控流道结构,流道主体1呈平面螺旋型结 构,可以应用于平板芯片中,例如图3所示的平板芯片。具体的,本申请提供的微流控流道 中,涉及的各部分结构的‘深度’,即是指各部分结构沿垂直于螺旋平面(或平板芯片的上下 两侧表面)方向的尺寸。本申请中,涉及的各部分结构的‘宽度’,是指垂直于液体流向(流道 延伸方向)的尺寸。上述的各部分结构包括进液流段2、流道主体1、出液流段3的各分支流路 31。 具体的,本申请实施例提供的微流控流道结构,流道主体1的两端(进液端和出液 端)分别与进液流段2和出液流段3相连,液体进入流道主体1后的走向依次为进液流段2、流 道主体1、出液流段3,其中,出液流段3包括至少两个分支流路31,该至少两个分支流路31与 出液端相连的一端端口分别沿流道主体1的内圈至外圈的方向上(各圈流道11的宽度方向 上)依次排列。 具体的,本申请实施例提供的微流控流道,将流道主体1设计为平面螺旋型结构, 且进液端位于内圈,出液端位于外圈,当液体从进液端进入后,在从内圈向外圈逐圈流动 时,液体内不同质量的物质粒子会在离心力的作用下发生分离,具体将沿内圈至外圈方向 上(各圈流道11的宽度方向上)逐渐形成各自独立的流淌区带,进而,在最终到达出液端时, 液体内不同质量的物质粒子将分别进入出液流段3的不同分支流路31,进而从不同分支流 路31流出,从而可以实现对液体中不同质量的组分进行分离。 具体的,当将该微流控流道应用于等速电泳分离技术时,该微流控流道的离心分 5 CN 111589479 A 说 明 书 4/6 页 离技术效果与等速电泳分离技术效果相结合,可以通过一次性操作有效提高样本组分混合 物的分离程度,无需接续其他辅助分离技术,可以简化流程,降低分离成本。 例如,一些实施例中,如图2和图3所示,本申请提供的微流控流道还包括一对电泳 电极,该一对电泳电极中的两种电极(正电极41和负电极42)分别设置在所述至少两个分支 流路31的出口30以及所述进液流段2的进口20处。 示例性的,可以是正电极41设置进液流段2的进口20处,负电极42设置在出液流段 3的出口30处,也可以是,负电极42设置进液流段2的进口20处,正电极41设置在出液流段3 的出口30处。具体可以根据电泳粒子的电性决定。 示例性的,如图3所示,位于出液流段3的出口30处的一种电极(图3中以负电极42 为例)包括与各分支流路31一一对应的多个部分,每个部分位于各自对应的分支流路31的 出口30处。 一些实施例中,如图2和图3所示,出液流段3位于所述流道主体1的外侧;对于出液 流段3的各分支流路31,只要保证各分支流路31与所述出液端相连的一端沿内圈至外圈的 方向上依次排列即可,而各分支流路31的形状,长度和延伸方向等可不做限定。例如,各分 支流路31的长度可以相近,且沿所述流道主体1的内圈至外圈的方向上并行设置。或者,各 分支流路31的延伸方向也可以不一致,以便于对不同分支流路31流出物质进行分别接收。 一些实施例中,如图2和图3所示,所述进液流段2位于所述流道主体1的内侧,所述 进液流段2的进口20位于所述螺旋型结构的中心。 一些实施例中,所述流道主体1的螺旋型结构环绕呈3-6圈。即流道主体1具有3-6 圈流道11,例如,具体可以设置为3圈。此种设置,当样本液体沿螺旋型结构移动时其内部不 同质量的物质粒子可以在离心力的作用下充分分离,形成各自独立的流淌区带。 一些实施例中,所述出液流段3包括3-8个分支流路31。例如,具体可以设置为3个 分支流路31。 一些实施例中,所述流道主体1的各圈流道11呈扁平状,即各圈流道11的宽度远大 于深度。这样,可以使得样本液体内不同质量的物质粒子容易在沿内圈至外圈方向上(各圈 流道11的宽度方向上)形成各自独立的流淌区带。 具体的,所述各圈流道11的宽度与深度的尺寸比例为8-15。 示例性的,所述各圈流道11的宽度为1mm-2mm,所述各圈流道11的深度为0.1mm- 0.2mm。 示例性的,所述流道主体1的相邻圈流道11之间的间隔为3mm-7mm。 例如,各圈流道11的宽度与深度的尺寸比例可以为10。各圈流道11的宽度为 1.5mm,深度为0.15mm。相邻圈流道11之间的间隔为5mm。 示例性的,所述进液流段2的进口20的直径(开口的径向尺寸)可以为7mm-13mm,每 个所述分支流路31的出口30的直径可以为1.4mm-2.6mm。示例性的,进液流段2的进口20的 直径可以为10mm;分支流路31的出口30的直径可以为2mm。 具体的,进液流段2的进口20远大于流道主体1各圈流道11的宽度,可以方便液体 进入;出液流段3的出口30略大于各圈流道11的宽度,以便于液体流出。 具体的,本申请实施例还提供一种电泳芯片,如图3和图4所示,该电泳芯片包括芯 片本体5,所述芯片本体5具有如上述任一实施例中的微流控流道结构10。 6 CN 111589479 A 说 明 书 5/6 页 示例性的,如图3和图4所示,该电泳芯片可以包括一个进液口501和一个出液口 502,进液口501与进液流段2的进口20相连,出液口502与出液流段3的出口30相连。例如,出 液口502包括与各分支流路31的出口30一一对应的开口,每一个开口与其对应的分支流路 31的出口30连通。 示例性的,本申请实施例提供的电泳芯片可以包括基板51和盖板52两部分,具体 可以通过刻蚀工艺或镀膜工艺在基板51或盖板52上形成微流控流道的结构图案,然后再通 过将基板51和盖板52对合以形成微流控流道10结构。例如,基板51和盖板52可以为透明玻 璃板,可以便于进行工艺加工和对样本液体在流道中的移动进行观察。 示例性的,进液口501和出液口502既可以设置在基板51上,也可以设置在盖板52 上。例如,如图4所示,在盖板52上形成有微流控流道的结构图案,同时在盖板52上设置有进 液口501和出液口502。 具体的,样本溶液可以通过微量注射泵或通过移液枪注射到进液口501,然后进入 到微流控流道10中,在微流控流道结构10中发生电泳分离后通过出液口502流出微流控流 道10。 本申请实施例还提供的电泳芯片,可以将等速电泳分离与离心分离技术相结合, 使得样本分离程度提高;并且,该电泳芯片集成度较高,操作简单,流程简化,通过一次性电 泳操作即可以实现对样本组分混合物的分离,无需接续其他辅助分离技术;另外,该电泳芯 片制造难度小,成本较低。 本申请实施例还提供一种电泳分离检测系统,如图5所示,该电泳分离检测系统包 括荧光显微装置6,以及如上述任一项所述的电泳芯片5;所述荧光显微装置6用于对所述电 泳芯片5的微流控流道中流出的荧光信号进行检测读取。 示例性的,本申请实施例提供的电泳分离检测系统为等速电泳分离检测系统。即 样本溶液被限定在前导电解质(LE)以及尾随电解质(TE)之间进行流动分离。 示例性的,本申请实施例提供的电泳分离检测系统还可以包括其他装置或设备, 例如:配套试剂(盒),流体注入装置,如注射泵或移液枪,分离物质接收试剂盒,等等。 具体的,基于与本申请实施例提供的微流控流道、电泳芯片以及电泳分离检测系 统相同的发明构思,本申请实施例还提供一种电泳分离检测系统的使用方法,如图6所示, 该方法包括以下步骤: 步骤101,对样本溶液进行荧光标记; 步骤102,向如上述任一项所述的微流控流道中依次通入前导电解质(LE)、被荧光 标记的样本溶液,以及尾随电解质(TE); 步骤103,向微流控流道两端的一对电泳电极施加电压,以开始进行等速电泳分 离; 步骤104,通过荧光显微装置对所述至少两个分支流路的出口处的荧光信号进行 检测读取。 具体的,如图3和图4所示,一对电泳电极(正电极41和负电极42)分别位于微流控 流道10的进口20和出口30处,可与注入微流控流道10中的溶液接触并在溶液中提供强电 场,LE、样本物质、TE在电场作用下同时从一侧电极向另一侧电极移动(如图3中为从正电极 41向负电极42移动),由于淌度差异,LE移动较快,样本次之,TE最慢,行进过程中样本物质 7 CN 111589479 A 说 明 书 6/6 页 位于LE、TE之间,样本内各组分根据淌度不同将沿流道11延伸方向上逐渐形成各自独立的 电泳区带,并在区带内富集聚焦;同时,组分区带内部的各粒子将根据密度大小不同沿流道 11宽度方向上逐渐形成各自独立的流淌区带;进而,样本内各组分将依次到达出液端并从 出液流段3依次流出,同时组分内部各粒子将分别进入不同的分支流路31,最终从不同的分 支流路31的出口30流出。具体的,此时,可以在出口30处进行荧光检测以对流出物进行的监 控和读取。 本实施例提供的电泳分离检测系统的使用方法中,主要将等速电泳技术与离心分 离技术相结合,在同一芯片上集成两种分离操作,从而达到增强分离效果、缩短实验流程的 目的。该方法的原理是将一般等速电泳使用的直线型流道改为螺旋型结构,从芯片螺旋型 流道的中心进样,外周流出;液体中的各样本组分经过螺旋流道时,除了依据淌度不同形成 组分区带之外,各组分内部粒子还会因所受离心力大小的不同得到进一步区分,其中密度 较大的粒子具有较大的离心力,主要集中在流道外侧,运动距离较长,而密度较小的粒子则 集中于流道内侧;当运动至流道的出液端时,不同密度的粒子可以进入不同的分支流道从 而实现分离。 例如,一种具体的实施例中,LE缓冲液为:100mM HCl,200mM Tris,and1%PVP;TE 缓冲液为:100mM HEPES and 200mM tris;样本溶液为以下六种物质的混合溶液:高电荷的 100bp DNA、500bp DNA、1000bp DNA,以及低电荷的1000Da蛋白质、5000Da蛋白质、10000Da 蛋白质;其中,bp和Da数值越高,物质质量越大。 具体的,如图3所示,设置微流控流道具有3圈流道11,且出液流段3包括3个分支流 路31。当向微流控流道中的一对电泳电极施加电压以进行等速电泳分离后,通过荧光显微 装置可以检测到各分支流路流出离子的情况如下:三种DNA首先流出,其中,低质量的100bp DNA从靠近螺旋中心的分支流路的出口流出,中等质量的500bp DNA从中间的分支流路的出 口流出,高质量的1000bp DNA从远离螺旋中心的分支流路的出液口流出;三种蛋白质随后 流出,同DNA类似,1000Da、5000Da、10000Da三种质量的蛋白质分别从靠近螺旋中心、中间、 远离螺旋中心这三个分支流路的出口流出。 当然,本申请实施例提供的电泳分离检测系统并不限于上述使用方法,即其使用 方法不限于用于等速电泳分离检测,也可以应用于与等速电泳分离检测原理类似的其他检 测。 要说明的是,本公开的一些实施例中,电泳芯片和电泳分离检测系统中还可以包 括其他结构,这可以根据实际需求而定,此处不再赘述。另外,微流控流道结构的流道主体 圈数和分支流路的数量,以及各部分尺寸比例等并不限于上述实施例中的记载,具体可以 根据实际需求进行调整,本公开的实施例对此不作限制。本申请中所涉及到的具体尺寸数 值允许具有一定的误差,误差可以在5%范围内。 另外,本申请的附图仅用于示意性的说明其结构形状和大概比例,并不对本公开 实施例微流控流道结构的具体尺寸和比例进行限制。 显然,本领域的技术人员可以对本申请实施例进行各种改动和变型而不脱离本申 请的精神和范围。这样,倘若本申请的这些修改和变型属于本申请权利要求及其等同技术 的范围之内,则本申请也意图包含这些改动和变型在内。 8 CN 111589479 A 说 明 书 附 图 1/3 页 图1 图2 9 CN 111589479 A 说 明 书 附 图 2/3 页 图3 图4 10 CN 111589479 A 说 明 书 附 图 3/3 页 图5 图6 11












