技术摘要:
本发明公开肿瘤标志物截断值联合模型,采用回归计算获得肿瘤标志物的截断(Cut‑off)值;肿瘤标志物包括CEA,CYFRA,NSE,CA125,CA153,CA199以及CA724;肿瘤标志物截断值联合模型建立方法包括以下步骤:(1)对患者各肿瘤标志物进行含量的测定;(2)Logistic回归分析获得 全部
背景技术:
肺癌是全世界所有癌症中最常见的死亡原因。肺癌的两种主要类型是小细胞肺癌 (SCLC)和非小细胞肺癌(NSCLC)。总体生存率取决于肺癌的分期,晚期肺癌患者一般预后较 差。有证据表明,肿瘤转移反映了肺癌的相对晚期,超过70%的患者死亡是由肿瘤转移引起 的。 据报道,复发和转移显著增加肺癌患者的死亡风险。非小细胞肺癌IB期患者的5年 总生存率为68%,而IVA-IVB期患者的5年总生存率低于10%。广泛期小细胞肺癌患者的中 位生存期为10~12个月。以前的一项研究报告显示,在不超过5个转移灶的非小细胞患者 中,适当的治疗可使13%的患者在3年内无进展,即使是IV期患者也可从根治性治疗中获 益。因此,转移灶的识别对新诊断肺癌患者临床治疗方案的选择及预后具有重要的指导价 值。 在临床上,当有完整的病理证据可用于肺癌的诊断时,通过临床症状和影像学证 据(计算机断层扫描(CT)、胸部X射线(CXR)、正电子发射断层扫描(PET-CT)和磁共振成像 (MRI)等)相结合的方法来确定转移。然而,高昂的检查费用等因素可能会给患者带来很大 的经济负担,阻碍临床监测和肺癌转移的早期发现。此外,患者可在某些区域发生转移,临 床症状不明显,容易被患者和医生忽视。因此,临床上急需既经济又简单的诊断技术来判断 是否发生了肿瘤转移,这有助于提示医生判断疑似转移症状的肺癌患者是否需要进行更详 细的检查。以血液为基础的生物标记物可以方便、快速、经济地获取,因此它们有可能极大 地提高评估的效率。临床辅助肺癌肿瘤诊断的传统而常用的肿瘤标志物包括癌胚抗原 (CEA)、细胞角蛋白抗原19片段(CYFRA)、神经元特异性烯醇酶(NSE)、糖类抗原(CA)系列,如 CA125、CA153、CA199、CA724等。 但是直接利用现在临床上设置的肿瘤标志物的参考上限(URL)值不能准确地判断 肿瘤患者的转移情况。
技术实现要素:
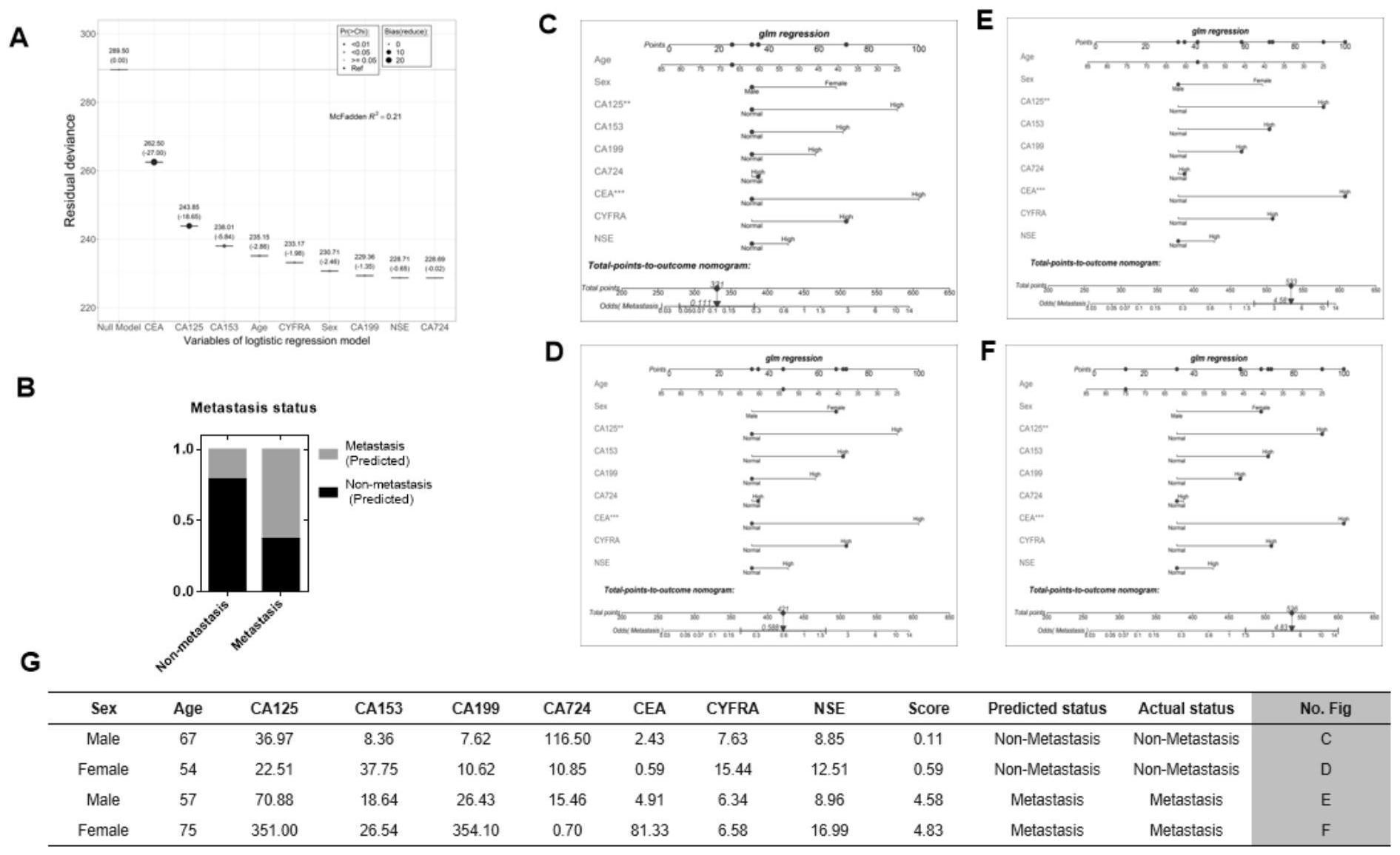
为解决以上现有问题,本发明提供肿瘤标志物截断值模型及其应用。本发明通过 以下技术方案实现。 肿瘤标志物截断值联合模型,采用logistic回归计算获得肿瘤标志物的截断 (Cut-off)值; 所述肿瘤标志物包括CEA,CYFRA,NSE,CA125,CA153,CA199以及CA724; 所述肿瘤标志物截断值模型建立的方法包括以下步骤: (1)对患者血清中的各肿瘤标志物进行含量的测定; (2)Logistic回归分析获得每一种肿瘤标志物的截断(Cut-off)值; 3 CN 111583994 A 说 明 书 2/6 页 (3)筛选与肿瘤转移相关的高危因素; (4)比较单一肿瘤标志物参考上限(URL)值与截断(Cut-off)值在评估肿瘤转移中 的性能; (5)建立基于多肿标的截断值(comb-cut-off)联合模型。 一种上述肿瘤标志物截断值联合模型的应用,用作新诊断为肺癌的患者肿瘤转移 诊断的工具。 本发明的有益效果: 本发明肿瘤标志物截断值联合模型及其应用 本发明通过对血清中肿瘤标志物的定量分析,通过罗氏公司的试剂盒及Roche E601系统对患者血清中7种肿瘤标志物(CEA,CA125,CA153,CA199,CA724,CYFRA和NSE)进行 含量的测定。这7种肿瘤标志物对非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)的发生有显著 的诊断作用,相对于现有技术,本发明通过检测肺癌患者血清的多种肿瘤标志物的含量,经 过比较分析建立肿瘤标志物截断值(comb-cut-off)联合模型,可用作肺癌肿瘤转移诊断的 工具,准确性高。 附图说明 图1为肺癌患者中转移组和非转移组的肿瘤标志物水平分布;横向的虚线为每一 种肿瘤标志物的参考上限值; 图2为年龄、性别和按Cut-off值分组的生物标记物的比值比(OR)示意图; 图3为基于肿瘤标志物测量值(Level)(A)、参考上限值(URL)(B)和截断(Cut-off) 值(C)的logistic回归模型的比较;其中(D)比较comb-cut-off模型和不考虑性别及年龄因 素调整的单一肿瘤标志物的logistic回归模型;(E)比较comb-cut-off模型和经过性别及 年龄因素调整的单一肿瘤标志物的logistic回归模型; 图4为回归模型预测肿瘤转移的Nomogram图及实例应用展示; 图5为决策树模型的性能。(A)决策树模型的规则,基于单一肿瘤标志物的测量值 和logistic回归模型与实际相比的性能;(B)决策树模型的性能。












