技术摘要:
本发明提供了一种扩增培养人肝祖细胞的培养基及其应用,所述培养基配方化学成分明确,无血清,各组分相互配合,协同增效,用于体外长期扩增培养肝祖细胞并维持其干性,有助于快速高效的获取大量的具有功能的肝细胞,适宜于临床肝细胞移植应用以及生物人工肝中的肝细胞 全部
背景技术:
我国是肝病大国,有超过1亿人群患有病毒性肝炎、脂肪肝和肝纤维化等各类肝 病,其中有约3000万的慢性肝炎患者是高风险人群,部分患者进行性发展为肝纤维化、肝硬 化、肝衰竭和肝癌等重症肝病。每年有超过100万新发病例进入肝硬化失代偿期,50万左右 死于肝衰竭,另有几千人死于食源或药源性肝中毒导致的肝衰竭,这些各类因素导致的肝 脏疾病造成巨大的社会和家庭负担。 目前治疗肝衰竭的唯一有效方法就是肝脏移植。我国每年等待肝移植的病人大于 50万,而能用于移植的肝脏来源数目在数百至一千余例,极其有限的肝脏器官来源远远不 能满足巨大而急迫的临床需求。已有的临床治疗和临床前研究表明,生物人工肝透析和肝 细胞移植,都有助于改善肝脏及全身微环境和生理状况,有利于肝脏修复并恢复肝脏功能。 这不仅有可能挽救中毒性急性肝衰竭,更重要的是对于一定程度的晚期肝病患者,能延缓 或阻止进入终末期肝衰竭。这两种治疗方法都需要用到大量的肝细胞。人原代肝细胞是理 想的种子细胞,主要从不适合肝移植标准的肝脏中获得。但是,原代肝细胞在体外不能培养 扩增,而且来源也受限于肝源供体短缺。近年来干细胞研究的前沿认知及新技术的涌现,为 这个突破带来了新的契机。 人多能干细胞(Human pluripotent stem cells,hPSC)包括人胚胎干细胞(Human embryonic stem cells,ESC)和人诱导性多能干细胞(Human induced pluripotent stem cells,iPSC),拥有的高度自我增殖能力和多向分化潜能,理论上可以诱导分化为人体所有 类型的细胞,包括成熟肝细胞。hPSC的肝系定向分化就是模拟体内肝脏的发育过程,依次将 其诱导为定型内胚层细胞,肝祖细胞(Hepatoblasts,HBs)和成熟肝细胞。由hPSC大量制备 临床应用的肝系供体细胞,还存在一定的困难,其主要障碍在于诱导hPSC肝系定向分化的 效率较低,以及难以维持所获的肝细胞在体外大量培养扩增。尤其是后者,难于获取所需要 的大量肝细胞。临床上肝细胞移植治疗肝病,预计每次移植治疗需要109级肝细胞,而应用 于生物人工肝和药物研发则需要更多的肝细胞。因此,快速高效的获取大量的具有功能的 肝细胞,应用于细胞移植和生物人工肝透析等肝病治疗具有重要意义。 在体外培养条件下,分化成熟的肝细胞难以长期培养扩增,并维持其固有的细胞 特性。与之相比,HBs具有较强的增殖能力,同时具有快速向肝细胞和胆管细胞分化的双潜 能。因此,规模化扩增hPSC诱导分化来源的HBs,使其快速稳定增殖,并保持良好的分化状 态,是获取大量具有功能的肝细胞的理想方法。一方面可以冻存HBs,建立HBs库,以便快速 高效的获取大量种子细胞;另一方面可以进一步将HBs快速诱导分化为成熟的肝细胞或者 胆管细胞;同时该方法可以为肝系细胞库的建立提供可行的技术支持。 近几年,有多个实验室相继报道了扩增HBs的相关研究。但是,这些研究报道大多 4 CN 111607556 A 说 明 书 2/9 页 以少数几种HBs的标志蛋白来评估扩增后的HBs的双潜能特性,而且缺乏很多相关的细胞功 能评估。另外,部分HBs的扩增方法的培养条件中采用了滋养层细胞,或者使用了胎牛血清 等成分不明确的添加物。然而,将用于细胞治疗的肝细胞污染有动物血清、蛋白或者其他细 胞时,常在临床应用中引起急性免疫排斥反应及潜在的动物病毒感染。因此,这样培养获取 的肝细胞将不适合临床应用,这也是体外扩增培养HBs时应充分考虑的因素。 目前业内尚未建立在体外长期培养扩增HBs的有效方法,其难点在于hPSC向肝系 细胞分化过程和调控机制还缺乏深入的了解,以及HBs增殖和干性维持的调控机理尚未清 楚。 因此,阐明hPSC肝系定向分化的调控机理,厘清HBs增殖和干性维持的调控机理, 并建立化学成分明确和无血清配方的HBs扩增培养方法,规模化扩增培养HBs,将有助于快 速高效的获取大量的具有功能的肝细胞,应用于细胞移植和生物人工肝透析等肝病治疗, 具有广阔的应用前景和巨大的市场价值。
技术实现要素:
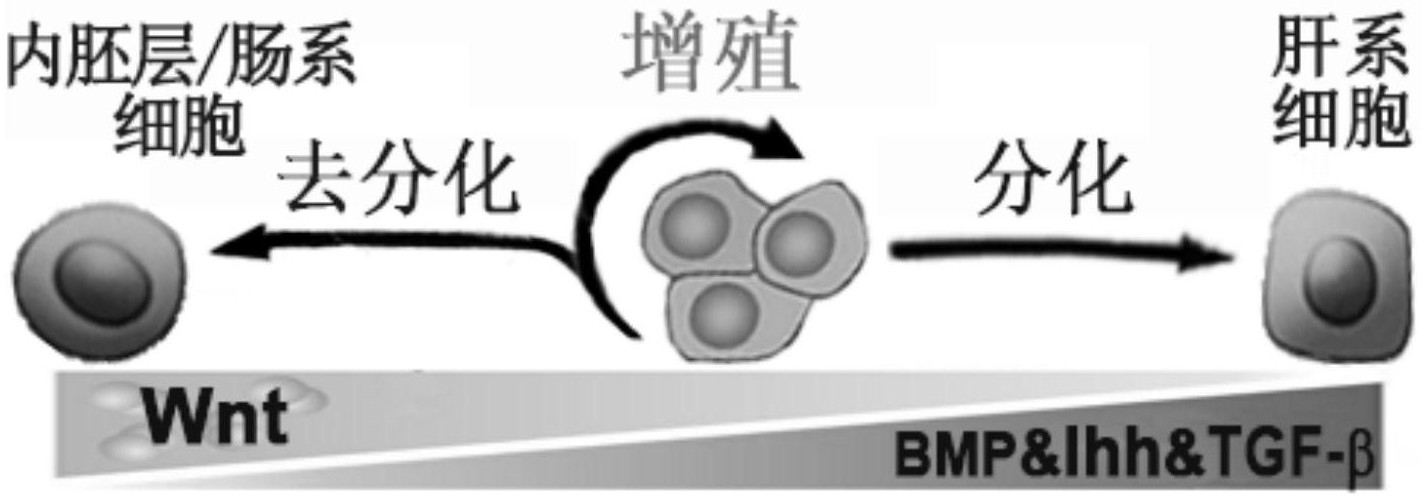
针对现有技术的不足及实际的需求,本发明提供一种扩增培养人肝祖细胞的培养 基及其应用,所述培养基配方化学成分明确,各组分相互配合,协同增效,用于人肝祖细胞 的体外扩增培养并维持其干性,具有广阔的应用前景和巨大的市场价值。 为达此目的,本发明采用以下技术方案: 第一方面,本发明提供一种扩增培养人肝祖细胞的培养基,所述培养基包括液体 基础培养基、胰岛素-转铁蛋白-亚硒酸钠混合液、细胞因子、糖原合成激酶3β抑制剂、 Hedgehog信号通路激活剂和转化生长因子受体β抑制剂。 优选地,所述培养基还包括白蛋白。 本发明中,发明人在长期科研实践过程中,已经建立肝系定向分化诱导方法的基 础上,分析肝祖细胞(HBs)增殖和分化相关的信号通路,厘清Wnt、TGF-β、BMP和Hedgehog等 关键信号通路对HBs增殖和肝祖特性维持的调控机制;并进一步用细胞因子以及小分子化 合物去调控相关的信号通路,全面筛选活性组分,以开发出支持HBs稳定增殖同时较好的维 持其肝祖特性的培养基配方,各组分各条件相互配合促进,协同增效,规模化培养扩增获取 的HBs,能较好的维持其HBs的特性,包括可以直接快速分化为具有功能的成熟肝细胞或者 胆管细胞,移植到肝损伤模型小鼠体内,可以归巢定植到肝脏组织中,增殖并进一步分化为 表达人ALB的肝细胞和表达人CK19的胆管细胞,参与肝实质组织的修复以及胆管的重建,有 效恢复损伤肝脏的功能,并拯救肝损伤模型动物。 优选地,所述液体基础培养基包括RMPI1640细胞培养基、DMEM/F12细胞培养基、 MEM细胞培养基、DMEM细胞培养基、IMDM细胞培养基、199细胞培养基或F10细胞培养基中的 任意一种或至少两种的组合。 优选地,所述白蛋白包括人重组白蛋白和/或牛血清白蛋白。 优选地,所述白蛋白的质量浓度为5-500μg/mL,例如可以是5μg/mL、20μg/mL、40μ g/mL、60μg/mL、80μg/mL、100μg/mL、200μg/mL、300μg/mL、400μg/mL或500μg/mL。 优选地,所述细胞因子包括骨形态发生生长因子、肝细胞生长因子和表皮生长因 子。 5 CN 111607556 A 说 明 书 3/9 页 优选地,所述骨形态发生生长因子包括BMP2和/或BMP4。 优选地,所述骨形态发生生长因子的质量浓度为1-50ng/mL,例如可以是1ng/mL、 5ng/mL、10ng/mL、15ng/mL、20ng/mL、25ng/mL、30ng/mL、35ng/mL、40ng/mL、45ng/mL或50ng/ mL。 优选地,所述肝细胞生长因子的质量浓度为1-100ng/mL,例如可以是1ng/mL、 10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL或 100ng/mL。 优选地,所述表皮生长因子的质量浓度为1-200ng/mL,例如可以是1ng/mL、10ng/ mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、 120ng/mL、140ng/mL、160ng/mL、180ng/mL或200ng/mL。 优选地,所述胰岛素-转铁蛋白-亚硒酸钠混合液的体积百分含量为0.1-10%,例 如可以是0.1%、0.2%、0.4%、0.5%、0.6%、0.8%、1%、2%、3%、4%、5%、6%、7%、8%、 9%或10%。 优选地,所述糖原合成激酶3β抑制剂包括CHIR99021和/或CHIR98014。 优选地,所述糖原合成激酶3β抑制剂的摩尔浓度为10nM-100μM,例如可以是10nM、 100nM、30μM、40μM、50μM、60μM、70μM、80μM、90μM或100μM。 优选地,所述转化生长因子受体β抑制剂包括A8301、SB431542或E-616452中的任 意一种或至少两种的组合。 优选地,所述转化生长因子受体β抑制剂的摩尔浓度为50nM-50μM,例如可以是 50nM、100nM、10μM、20μM、30μM、40μM或50μM。 优选地,所述Hedgehog信号通路激活剂包括SAG和/或Purmorphaminede。 优选地,所述Hedgehog信号通路激活剂的摩尔浓度为10nM-50μM,例如可以是 10nM、100nM、10μM、20μM、30μM、40μM或50μM。 所述的GSK3β抑制剂可以是CHIR99021或者其他小分子或者蛋白的GSK3β抑制剂。 所述的TGF-β受体抑制剂可以是A8301、SB431542和E-616452,或者其他TGF-β受体 抑制剂。 所述的Hedgehog信号通路激活剂可以是SAG或者Purmorphaminede等其他 Hedgehog信号通路激活剂。 具体地,培养基包括:液体基础培养基,5-500μg/mL的人重组白蛋白或者牛血清白 蛋白;0.1%-10%(体积百分含量)胰岛素-转铁蛋白-亚硒酸钠混合液(ITS);10nM-10μM的 糖原合成激酶3β(GSK3β)抑制剂;50nM-50μM的转化生长因子β(TGF-β)受体抑制剂;1-50ng/ mL的骨形态发生生长因子(BMP2或者BMP4);1-100ng/mL的肝细胞生长因子(HGF);1-200ng/ mL的表皮生长因子(EGF);10nM-50μM的Hedgehog信号通路激活剂。 第二方面,本发明提供一种长期体外扩增培养人肝祖细胞(HBs)的方法,采用第一 方面所述的培养基。 优选地,所述方法包括如下步骤: (1)获取Ep-CAM /C-kit-的HBs; (2)采用第一方面所述培养基对步骤(1)获取的细胞进行体外培养传代; 优选地,步骤(1)所述HBs的来源包括人多能干细胞hPSC、肝脏干细胞、肝母细胞或 6 CN 111607556 A 说 明 书 4/9 页 卵圆细胞中的任意一种或至少两种的组合。 步骤1)中所述的HBs包括从人多能干细胞hPSC诱导分化获得的HBs,以及其他途径 来源的HBs,包括人成体肝脏组织来源的肝脏干细胞、肝母细胞、卵圆细胞等。 优选地,步骤(1)所述获取的方法包括流式细胞术分选。 作为优选技术方案,一种长期体外扩增培养人肝祖细胞HBs的方法,具体包括如下 步骤: (1)流式细胞术分选获取Ep-CAM /C-kit-的HBs,所述HBs的来源包括人多能干细胞 hPSC、肝脏干细胞、肝母细胞或卵圆细胞中的任意一种或至少两种的组合; (2)采用第一方面所述培养基对步骤(1)获取的细胞进行体外培养传代,获取足量 的HBs; (3)将步骤2)获得的HBs进一步分化为功能成熟的肝细胞或者胆管细胞。 第三方面,本发明提供一种人肝祖细胞HBs,采用第一方面所述培养基或第二方面 所述方法扩增培养得到。 本发明提供的HBs可在所述培养基下培养超过50代,并维持稳定的HBs表型和相关 功能,包括可以直接快速分化为具有功能的成熟肝细胞或者胆管细胞。 第四方面,本发明提供一种如第三方面所述的HBs在制备治疗肝脏疾病的移植细 胞、生物人工肝反应器所用的肝细胞、肝脏组织工程或肝脏疾病体外药物筛选中的应用。 本发明提供了一种体外长期扩增培养HBs并维持其干性的体系和方法,包括一种 化学成份明确的扩增培养基,用于人HBs的体外扩增培养。本发明可以选择性的培养扩增从 hPSC分化获得的HBs,在此培养条件下,HBs可以规模化培养扩增超过50代,并维持稳定的 HBs表型,包括可以直接快速分化为功能成熟的肝细胞或者胆管细胞,扩增的HBs移植到肝 损伤模型小鼠体内,可以归巢定植到肝脏组织中,增殖并进一步分化为表达人ALB的肝细胞 和表达人CK19的胆管细胞,参与肝实质组织的修复以及胆管的重建,有效恢复损伤肝脏的 功能,并拯救肝损伤模型动物。 与现有技术相比,本发明具有如下有益效果: 本发明提供了一种化学成分明确和无血清的培养基配方和培养方法,用于体外长 期扩增培养由hPSC诱导来源的HBs,有助于快速高效的获取大量的具有功能的肝细胞,HBs 可在此条件下培养超过50代,并维持稳定的HBs表型和相关功能,包括可以直接快速分化为 具有功能的成熟肝细胞或者胆管细胞;本发明所培养的HBs移植到肝损伤模型小鼠体内,可 以归巢定植到肝脏组织中,参与肝实质组织的修复以及胆管的重建,有效恢复损伤肝脏的 功能,并拯救肝损伤模型动物;因此,该发明将有助于快速高效的获取大量的具有功能的肝 细胞,适宜于临床肝细胞移植应用以及生物人工肝中的肝细胞反应器等使用。 附图说明 图1(A)为本发明的诱导hPSC肝系定向分化的流程图; 图1(B)为本发明的HBs诱导过程中的细胞形态学变化; 图1(C)为本发明的诱导至第3天的DE细胞和第10天的HBs的免疫荧光鉴定图; 图1(D)为本发明的流式细胞术分析HBs分化过程中不同阶段的标志蛋白的表达以 及细胞增殖标志蛋白Ki67的表达图; 7 CN 111607556 A 说 明 书 5/9 页 图2(A)为本发明的RT-PCR定量分析HBs增殖与分化相关的信号通路活性图; 图2(B)-图2(D)为本发明的小分子调控相关信号通路对HBs增殖和分化的影响图; 图2(E)为本发明的信号通路调控HBs增殖和分化的模式图; 图2(F)为本发明的筛选细胞因子和小分子化合物模式图; 图2(G)为本发明的不同培养基配方对HBs增殖的影响图; 图2(H)为本发明的不同培养基配方对HBs增殖影响的细胞形态图; 图2(I)为本发明的不同培养基配方对HBs特性维持的影响图; 图2(J)为本发明的不同培养基配方对HBs相关基因表达影响的分析图; 图3(A)为本发明的流式分选纯化hPSC诱导来源的HBs; 图3(B)为本发明的分选HBs在扩增培养条件下形成克隆的能力图; 图3(C)-图3(D)为本发明的长期扩增后的HBs依然维持较高的增殖能力图; 图3(E)为本发明的HBs标志性蛋白表达的检测图; 图3(F)-图3(G)为本发明的转录组对比分析扩增前后的HBs结果图; 图4(A)为本发明的扩增后的HBs分化为成熟肝细胞的形态图; 图4(B)为本发明的扩增后的HBs分化为肝细胞表达标志性蛋白图; 图4(C)-图4(F)为本发明的诱导分化获取的肝细胞的代谢解毒、合成白蛋、尿素、 糖原的功能鉴定图; 图4(G)为本发明的HBs分化为胆管上皮细胞以及胆管结果图; 图5(A)为本发明的HBs移植实验示意图; 图5(B)为本发明的HBs移植前后的动物存活率分析图; 图5(C)为本发明的病理切片分析细胞移植前后肝组织的形态结构图; 图5(D)-图5(F)为本发明的肝组织切片分析细胞移植一周后的细胞归巢效率分析 图; 图5(G)为本发明的移植的HBs分化为胆管上皮细胞,再生胆管图; 图5(H)为本发明的移植HBs的小鼠血清中人源白蛋白的分泌图; 图5(I)为本发明的肝组织切片分析细胞移植4周后的人源肝细胞图。












