技术摘要:
本发明提供一种卵巢滤泡膜干细胞及其分离方法、培养方法和应用,涉及干细胞与组织工程技术领域。卵巢滤泡膜干细胞的分离方法,包括以下制备方法:获取卵巢组织:从生育力和卵巢功能正常,年龄为4~10岁的雌性食蟹猴,获取卵巢组织,剥离卵巢组织周围脂肪,保留卵巢皮质 全部
背景技术:
随着生育年龄推迟,生活压力及环境因素影响,由性腺衰老导致的不孕不育现象 明显增多。过去十年,我国育龄人群的不孕不育率已达到15%左右,每8对育龄夫妇中就有1 对不孕不育患者。二孩政策的放开也给生殖健康带来了新的挑战:50%可生育二孩的女性 年龄超过40岁高龄,导致生育力严重下降。同时卵巢衰老也直接加剧了人体的衰老速度。因 此,如何有效治疗卵巢衰老,延缓机体衰老是我们面临的重要议题。生育力的核心之一是生 殖细胞,它们也是生育力环节中最为重要的种子。同时,生殖细胞并不是孤立的,性腺体细 胞增殖分化及激素分泌等功能的存在是维持生殖细胞正常发育的重要保障,因此,欲延缓 衰老和重建生育力,为生殖细胞提供一个适宜发育的土壤微环境,也是至关重要的环节。 卵巢功能低下等系列疾病体现为卵子数量减少和/或质量低下、排卵障碍、不孕和 生殖内分泌紊乱等问题,卵巢功能疾病主要包括卵巢早衰(premature ovarian failure, POF)、卵巢储备功能降低(diminished ovarian reserve,DOR)、早发性卵巢功能不全 (premature ovarian insufficiency,POI)和卵巢低反应(poor ovarian response,POR) 等。以卵巢早衰为例,该疾病的诱因较为复杂,目前尚未完全清楚,已知影响因素主要包括: 遗传学因素(如脆性X染色体等)、激素合成的相关代谢酶缺乏、蛋白及受体缺陷、免疫因素、 感染因素、化疗放疗等医源性因素,这些因素往往加速卵泡闭锁。卵巢早衰的治疗方式主要 是激素替代疗法、低温冻存卵子、卵巢移植、免疫疗法乃至心理治疗法等,这些治疗方式也 存在一定的风险及副作用,目前没有特效的治疗方式,因此亟待寻求新的治疗方式。 卵巢滤泡膜细胞(theca cell,TC)是一群与雄性睾丸中分泌雄激素的睾丸间质细 胞类似的细胞类型,是卵巢中合成雄激素的主要来源,产生的雄激素转运至颗粒细胞作为 合成雌激素的底物,因此该细胞有可能成为治疗卵巢功能低下等系列疾病的种子细胞。卵 巢滤泡膜干细胞(thecal stem cell,TSC)是一群具有自我更新能力的细胞类型,可分化为 TC。目前对TSC的研究甚少,由于生物体内的TSC来源不明确,在卵巢中数量有限,已有报道 从小鼠和猪全卵巢中可以分离得到TSC。灵长类动物与人类亲缘关系更为接近,其卵巢结构 及生理周期与人类似,但其TSC的分离尚未见报道。已有的TSC的获取大多采用全卵巢分离 的方式,损伤较大,也不利于开展自体移植治疗。 而本专利可采用微创获取猴卵巢皮层少量组织的方式,分离获得了TSC,并通过改 良培养条件大量扩增该细胞并验证其功能,为后续该细胞的基础研究及临床转化应用研究 提供研究基础,为进一步推动人类卵巢功能低下等疾病的治疗具有重要意义。
技术实现要素:
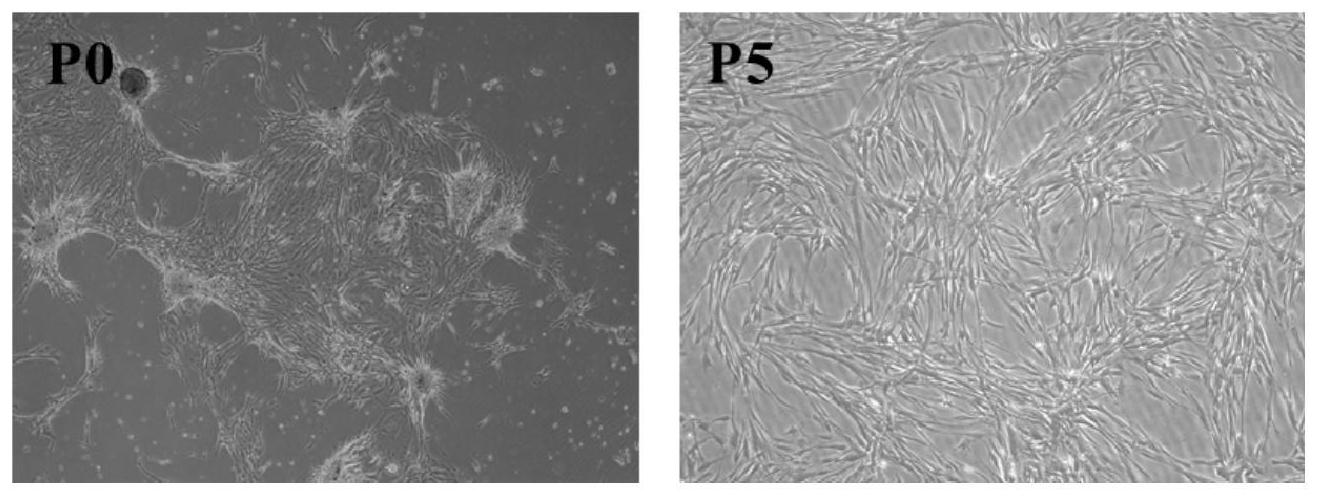
基于此,有必要针对上述问题,提供一种卵巢滤泡膜干细胞的分离方法,可以成功 3 CN 111593021 A 说 明 书 2/6 页 分离出猴卵巢滤泡膜干细胞,该细胞具有再生修复病损组织的功能。 一种卵巢滤泡膜干细胞的分离方法,包括以下制备方法: 获取卵巢组织:选择年龄为4~10岁的雌性食蟹猴,从生育力和卵巢功能正常的食 蟹猴卵巢获取卵巢组织,剥离卵巢组织周围脂肪,保留卵巢皮质基质,清洗,将卵巢皮质基 质剪成组织碎块; 培养:向组织碎块中加入培养基,离心,弃掉上清液,加入培养液重悬,孵育,离心, 弃掉上清液,加入培养液重悬,得到细胞悬液,接种培养,即得卵巢滤泡膜干细胞。 发明人采用本方法首次在灵长类动物获得卵巢滤泡膜干细胞。采用本发明的分离 方法得到的细胞从分子水平分析,能表达P75、Nestin、PDGFR-α,但不表达3β-HSD、LHR,符合 卵巢滤泡膜干细胞分子生物学特点,而且该细胞还具有自我更新能力,可成功分化为卵巢 滤泡膜细胞,说明本发明的方法能够从食蟹猴卵巢内成功得到卵巢滤泡膜干细胞。 在其中一个实施例中,所述获取卵巢组织步骤中,采用腹腔镜微创方式从生育力 和卵巢功能正常的食蟹猴卵巢剪取边长为1-5mm的方块卵巢皮层组织。采用微创方式取少 量组织,保留卵巢大部分结构,可获得大量用于研究及治疗的细胞,避免摘取卵巢对机体的 影响,也为后续自体细胞移植治疗的开发提供基础。 在其中一个实施例中,所述培养步骤具体为:将组织碎块离心,离心转速为1400~ 1600rpm,离心时间为4~6min,保留沉淀,加入培养液重悬,在37±0.5℃、5±0.5%CO2下孵 育时间为20~30h,离心,离心转速为1400~1600rpm,离心时间为4~6min,保留沉淀,加入 培养液重悬,得到细胞悬液,接种培养,即得卵巢滤泡膜干细胞。 在其中一个实施例中,所述培养步骤中的培养液DMEM-F12为基底液,包括以下浓 度的成分:0.8~1.2nM地塞米松、0.5~1.5ng/ml LIF、45~55ng/ml胰岛素、45~55ng/ml转 铁蛋白、45~55pg/ml亚硒酸钠、15~25ng/ml抑瘤素M(OSM)、1±0.1%V/V非必需氨基酸、1 ±0.1%V/V N2、2±0.1%V/V B27无血清添加剂、15~25ng/ml bFGF(成纤维细胞生长因 子)、15~25ng/ml EGF(表皮细胞生长因子)、15~25ng/ml PDGF-BB(血小板源性生长因 子)、0.05~0.15mMβ-巯基乙醇。该培养液中地塞米松,胰岛素,bFGF,EGF可以给细胞提供激 素和生长因子,促进细胞增殖,OSM抑制细胞分化,非必须氨基酸是细胞生长所必需的营养 物质,亚硒酸钠等可以提供微量元素,是细胞代谢解毒过程中具有重要作用,转铁蛋白作为 一种结合蛋白,在细胞代谢过程具有重要的作用。 本发明一方面还提供一种由上述方法得到的卵巢滤泡膜干细胞。 上述卵巢滤泡膜干细胞,表达并不限于Nestin,P75及PDGFR-α等特异性标志蛋白, 不表达但不限于Star,LHR及3β-HSD等特异性标志蛋白;该卵巢滤泡膜干细胞具有自我更新 能力,可以分化为卵巢滤泡膜细胞,分泌雄激素,具有修复病损组织的功能。 本发明一方面还提供一种卵巢滤泡膜干细胞的培养方法,包括以下步骤: 向上述卵巢滤泡膜干细胞中加入培养液进行传代培养,所述培养液以DMEM-F12为 基底液,包括以下浓度的成分:0.8~1.2nM地塞米松、0.5~1.5ng/ml LIF、45~55ng/ml胰 岛素、45~55ng/ml转铁蛋白、45~55pg/ml亚硒酸钠、15~25ng/ml抑瘤素M、1±0.1%V/V非 必需氨基酸、1±0.1%V/V N2、2±0.1%V/V B27无血清添加剂、15~25ng/ml bFGF、15~ 25ng/ml EGF、15~25ng/ml PDGF-BB、0.05~0.15mMβ-巯基乙醇。 本发明一方面还提供一种卵巢滤泡膜干细胞的分化方法,包括以下步骤: 4 CN 111593021 A 说 明 书 3/6 页 向上述卵巢滤泡膜干细胞中加入诱导培养基进行分化培养,所述诱导培养基以 DMEM-F12为基底液,包括以下浓度的成分:1.5~2.5%(V/V)FCS(小牛血清)、0.5~1.5nM T3(羊胚胎因子)、0.5~1.5ng/ml LH(黄体生成素)、65~75ng/ml IGF-1(促生长因子)、5~ 15ng/ml PDGF-BB、45~55ng/ml胰岛素、45~55ng/ml转铁蛋白、45~55pg/ml亚硒酸钠。 上述分化方法中,诱导培养基中LH可以作用于卵巢滤泡膜细胞的LHR受体促进TSC 向TC的分化,而羊胚胎因子,促生长因子,胰岛素等可以为细胞增殖分化提供必需的生长因 子及激素,这些成分在促进细胞增殖的同时,也促进了细胞分化,所以可以诱导卵巢滤泡膜 干细胞分化为卵巢滤泡膜细胞。 本发明一方面还提供一种由上述分化方法得到的卵巢滤泡膜细胞。 本发明一方面还提供一种巢滤泡膜干细胞在制备治疗卵巢功能疾病药物中的应 用。本发明的卵巢滤泡膜干细胞可以提高血清AMH水平,提升卵巢功能。 与现有技术相比,本发明具有以下有益效果: 本发明的分离方法,能够从食蟹猴卵巢内成功得到卵巢滤泡膜干细胞,得到的细 胞从分子水平分析,能表达P75、Nestin、PDGFR-α,但不表达3β-HSD、LHR,符合卵巢滤泡膜干 细胞分子生物学特点,而且该细胞还具有自我更新能力,可成功分化为卵巢滤泡膜细胞;本 发明的卵巢滤泡膜干细胞可以提高血清AMH水平,提升卵巢功能。 本发明的分化方法,可以诱导卵巢滤泡膜干细胞分化为卵巢滤泡膜细胞。 附图说明 图1为卵巢滤泡膜干细胞体外培养的形态图; 图2为卵巢滤泡膜干细胞表达特异性标志蛋白情况; 图3为单个卵巢滤泡膜干细胞增殖细胞形态图; 图4为卵巢滤泡膜干细胞的扩增数量和时间关系图; 图5为卵巢滤泡膜干细胞的定向分化表达图; 图6为卵巢滤泡膜干细胞分化后表达雄烯二酮的数量和时间关系图; 图7为卵巢滤泡膜干细胞移植后激素变化图; 图8为卵巢滤泡膜干细胞在卵巢内定植分化情况; 图9为对比例细胞形态图。












