技术摘要:
本发明公开了巴弗洛霉素A1在诱导白血病细胞逆编程成为造血干祖细胞中的应用,并且该巴弗洛霉素A1有望应用于制备治疗急性B淋巴白血病的药物中。使没有完全分化的白血病细胞正向分化为成熟血细胞的诱导分化策略已成功地应用于儿童早幼粒白血病治疗。本发明首次采用天然化 全部
背景技术:
急性B淋巴细胞白血病(B-cell Acute Lymphoblastic Leukemia,B-ALL)是指前 体或者成熟B淋巴细胞发生克隆性异常增殖所致的恶性疾病。B-ALL对化疗药物敏感,但化 疗药物同时也杀死正常功能血细胞,极易发生粒细胞缺乏而导致重症感染,同时降低患者 的免疫能力,使感染进一步加重,继而危及生命。造血干细胞移植是目前治疗白血病的最有 效手段,但缺乏合适供体、预处理方案的毒副反应等因素限制了造血干细胞移植在大多数 患者治疗中的应用,而且移植物抗宿主病(GVHD)、移植后复发、感染等因素也极大的影响了 移植后患者的长期生存。 近年来,临床试验结果证明通过靶向CD19,CD20或CD30的CAR-T细胞对B-ALL是有 疗效的,CAR-T细胞治疗B-ALL也取得重大突破。尽管CAR-T细胞治疗为部分晚期肿瘤患者带 来治愈的希望,但CAR-T在治疗过程中也存在明显的副作用:①既攻击异常的B细胞,也攻击 正常的B细胞,可能导致B细胞不能正常产生抗体而发生感染致死,也可能引起细胞因子异 常释放和严重过敏反应而死亡;②而基于抑制免疫检控点的免疫疗法因可诱发过度免疫反 应或自身免疫反应也具有严重的治疗风险。当然,不断优化的免疫治疗方案有望在未来降 低治疗风险。 2006年,Yamanaka等研究者使用与调控胚胎干细胞多能性密切相关的Oct4、Sox2、 Klf4、c-Myc四种转录因子,成功将小鼠胚胎成纤维细胞和成体成纤维细胞诱导为多潜能干 细胞,并称其为诱导性多潜能干细胞(induced pluripotent stem cell,iPSC)。诱导性多 能干细胞避免了伦理问题和免疫排斥问题,这一发现为肿瘤逆编程疗法的尝试提供了启 示。2007年,Jaenisch实验室将iPSC技术应用于镰刀型贫血的小鼠模型的治疗上,提出用 iPSC治疗单基因遗传疾病。2009年,高绍荣课题组将这一策略应用于地中海贫血症患者来 源的细胞,获得病人特异的功能恢复的造血细胞。在白血病逆分化方面,Carette等(2010)、 Kumano等(2012)、程涛课题组(2014)在白血病细胞中尝试通过导入Yamanaka四个转录因子 获得iPSC,但这些iPSC会诱发白血病。这些研究对于白血病治疗是一项重要的探索,但也提 示,用Yamanaka四个转录因子可能无法使白血病细胞逆编程为正常的造血干细胞。 iPSC技术一直受困于逆编程方法的安全隐患和低效率两大难题,不能真正用于临 床治疗。目前使用最为广泛的通过病毒载体将因子(Oct4,Sox2,Klf4,c-Myc)随机整合入体 细胞基因组获得iPSC的方法仍存在缺陷。逆转录病毒与转录因子本身都存在风险,尤其是 c-Myc,在约70%的人类肿瘤细胞中都可检测到其表达,故在应用中存在肿瘤发生的可能。 Nakagawa等研究表明,使用包括c-Myc在内的四种因子诱导MEF细胞时,得到的嵌合体小鼠 有15%会出现肿瘤。 3 CN 111607567 A 说 明 书 2/6 页 近年来,iPSC技术发展迅速,科学家进行了大量尝试,影响基因组稳定性的逆转录 病毒可以用腺病毒、瞬时表达质粒甚至mRNA或重组蛋白来代替,一些逆编程因子也不断被 发现可以被化学小分子所取代。2013年邓宏魁研究团队使用小分子化合物成功地诱导小鼠 体细胞逆分化为多潜能干细胞。这种由化合物诱导得到的iPSC,被称为化合物诱导性多能 干细胞(chemical induced pluripotent stem cell),简称CiPSC。这种新方法没有引入任 何外源基因,解决了转录因子诱导iPSC的安全问题,不仅能提高逆分化的效率或替代某些 转录因子,还能帮助我们探究逆编程的机制。但是,CiPSC诱导逆编程成功尚局限于小鼠正 常体细胞,而不是癌细胞。 综上,研发高效、低毒无毒药物,克服原发性和继发性耐药,探索新的防治方案,提 高包括B-ALL在内的各种白血病治愈率仍是血液肿瘤研究者面临的重要课题。
技术实现要素:
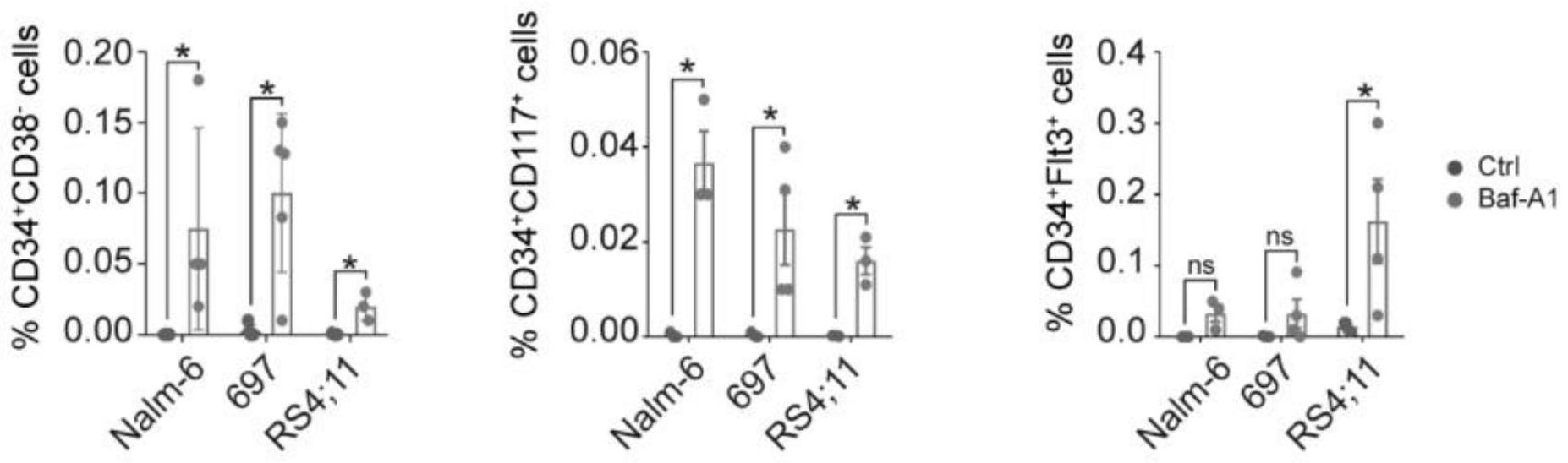
针对现有技术存在的不足,本发明的目的在于提供一种巴弗洛霉素A1在诱导白血 病细胞逆编程成为造血干祖细胞中的应用。 为实现上述技术目的,达到上述技术效果,本发明通过以下技术方案实现: 本发明公开了巴弗洛霉素A1的一种新应用,即巴弗洛霉素A1可以用于诱导白血病 细胞逆编程成为造血干祖细胞。 进一步的,巴弗洛霉素A1可以用于制备治疗急性B淋巴白血病的药物。 本发明所述的巴弗洛霉素A1(Bafilomycin A1,简称Baf-A1)源自灰色链霉菌,是 大环内酯类抗生素家族中的一员,其化学式为C35H58O9,其分子结构式如下: Baf-A1对细菌、酵母菌、真菌、线虫、昆虫和肿瘤细胞系等具有广泛的生物活性,还 具有一定的免疫抑制作用。中高浓度(10-100nM)的Baf-A1常被用作自噬后期抑制剂,抑制 自噬溶酶体的形成。 本发明的发明人利用Baf-A1处理B-ALL细胞株和患者原代细胞后,发现残留的细 胞均表达造血干细胞(hematopoietic stem cell,HSC)特有的表面标志(CD34 CD38-Flt3 CD117 ),并表达造血干细胞特异性转录因子,细胞周期检测发现G0期细胞明显增多(干细 胞的特性之一是保持静息态)。 本发明的发明人运用经典的凋亡诱导剂喜树碱(Camptothecin,CPT),与Baf-A1分 别处理B-ALL细胞,发现尽管两者都能诱导B-ALL细胞凋亡,但只有Baf-A1能够特异性诱导 B-ALL细胞HSC标志表达增加,而CPT则不能;类似地,又发现Baf-A1能够特异性诱导B-ALL细 胞G0期细胞比例增加,而CPT则不能。 这一结果证明Baf-A1诱导B-ALL细胞HSC标志表达增加、G0期细胞比例增加,不是 源于不表达干细胞标志的细胞凋亡。更重要的是,诱导人B-ALL细胞逆编程的造血干祖细胞 4 CN 111607567 A 说 明 书 3/6 页 移植到NOD-SCID小鼠后,小鼠未出现白血病相关表型。 以上结果提示:Baf-A1诱导B-ALL白血病细胞逆编程为造血干祖细胞。从而足以证 明,Baf-A1可以在诱导白血病细胞逆编程成为造血干祖细胞中得以应用,同时Baf-A1有望 在制备治疗急性B淋巴白血病的药物中得以应用。 本发明的有益效果为: 使没有完全分化的白血病细胞正向分化为成熟血细胞的诱导分化策略已成功地 应用于儿童早幼粒白血病治疗。本发明首次采用天然化合物Baf-A1诱导白血病细胞逆编程 为造血干祖细胞,是一项不同于以往思路、反其道而行之的原创性探索。这对于制备治疗急 性B淋巴白血病的药物,探索白血病治疗新路径,具有重要意义。未来有可能通过此途径,拓 展并优化白血病的临床疗法,优化后的免疫治疗方案则有望在未来降低治疗风险,提高治 愈率。 上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段, 并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。 本发明的












