技术摘要:
本申请涉及一种基于比率荧光法的β‑半乳糖苷酶活力检测试剂盒,包括二‑β‑D‑吡喃半乳糖苷(FDG)和CdZnTeS量子点溶于反应缓冲液中所得的反应试剂,其中FDG的浓度为5‑15ng/mL,CdZnTeS量子点的浓度为15‑25nmol/mL。该检测试剂盒还可包括标准色卡和/或β‑半乳糖苷酶 全部
背景技术:
lacZ基因编码的β-半乳糖苷酶(β-Gal)是一种糖苷水解酶,可以催化β-半乳糖苷 的水解,去除鞘脂、糖蛋白、神经节苷脂和硫酸角蛋白中的半乳糖残基。β-半乳糖苷酶在食 品工业中的乳制品加工已得到广泛的应用,能将乳制品中的乳糖水解成半乳糖,降低乳制 品的乳糖含磷,提高乳制品的可消化性,可用于生产低乳糖牛奶,还可用于生产低聚半乳 糖。同时,在生物医学领域,已发现β-半乳糖苷酶在细胞衰老和原发性卵巢癌等癌症中过量 表达。癌症是目前全世界人口死亡的重要原因,准确的诊断对于癌症治疗至关重要,过量表 达的酶通常是癌症诊断中必不可少的标志物之一。因此,在食品工业领域、医疗诊断行业及 生物科研领域,都需要检测β-半乳糖苷酶的活力。 近年来,已经开发了几种用于β-半乳糖苷酶活力检测的方法,例如比色法、磁共振 成像法、表面增强拉曼散射法和荧光法。荧光方法由于其简单、灵敏、选择性高和非侵入性, 引起了人们的极大兴趣。然而,已开发的荧光方法仍存在一些局限性,例如单波长发射、量 子产率低、光稳定性差等缺点,尤其是可视化不佳,使用不方便。因此,本发明仍需要便捷的 β-半乳糖苷酶活力检测的方法。
技术实现要素:
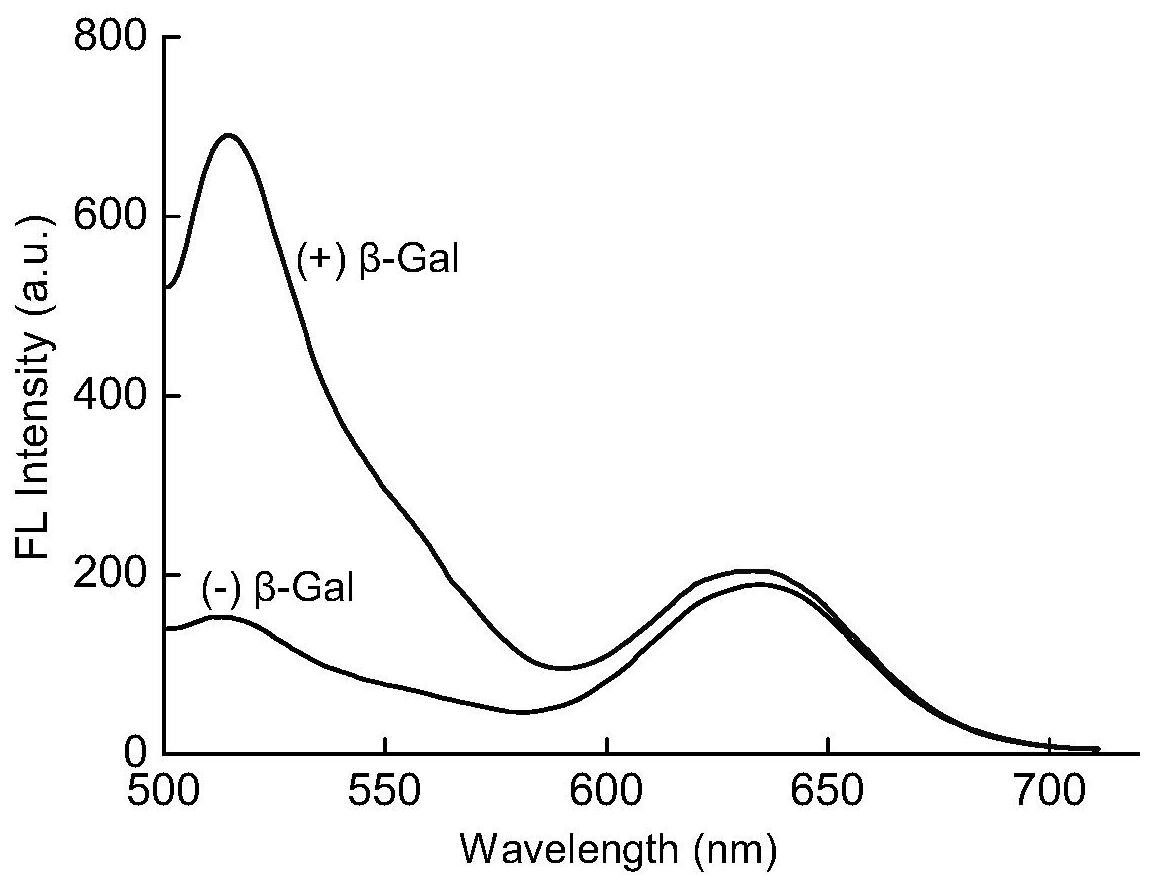
本发明的目的在于克服现有的β-半乳糖苷酶荧光检测方法可视化不佳的问题,而 提供一种基于比率荧光法的β-半乳糖苷酶活力检测试剂盒和采用该检测试剂盒检测β-半 乳糖苷酶的方法。 因此,在第一方面,本发明提供一种基于比率荧光法的β-半乳糖苷酶活力检测试 剂盒,其特征在于,该检测试剂盒包括二-β-D-吡喃半乳糖苷(FDG)和CdZnTeS量子点溶于反 应缓冲液中所得的反应试剂,FDG的浓度为5-15ng/mL,CdZnTeS量子点的浓度为15-25nmol/ mL。 在本发明的实施方案中,在反应试剂中,FDG的浓度可为5、6、7、8、9、10、11、12、13、 14或15ng/mL,CdZnTeS量子点的浓度可为15、16、17、18、19、20、21、22、23、24或25nmol/mL。 在本发明的一个优选实施方案中,在反应试剂中,FDG的浓度为10ng/mL,CdZnTeS量子点的 浓度为20nmol/mL。 进一步地,该反应缓冲液为Tris缓冲液或PBS缓冲液。优选地,该反应缓冲液为 Tris缓冲液。该反应缓冲液的pH为7.5-8.5,例如7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、 8.4或8.5,优选地为8.0。 进一步地,该检测试剂盒还可包括标准色卡,该标准色卡通过以下方法制作: (A)配制二-β-D-吡喃半乳糖苷(FDG)和CdZnTeS量子点溶于Tris缓冲液的反应试 4 CN 111593089 A 说 明 书 2/7 页 剂,其中FDG的浓度为10ng/mL,CdZnTeS量子点的浓度为20nmol/mL,反应缓冲液的pH为8.0; (B)取该反应试剂的等分试样,向其中加入或不加入β-半乳糖苷酶标准品,使β-半 乳糖苷酶浓度为0、50、100、150、200、250、300、350、400、450、500U/L,得到系列反应混合物; (C)将该系列反应混合物在32℃下温育60分钟以进行酶促反应,得到系列酶促反 应物; (D)用480nm激发波长激发该系列酶促反应物以显示系列发射荧光颜色,并获取该 系列酶促反应物的该系列发射荧光颜色的图像; (E)用该系列发射荧光颜色的图像按β-半乳糖苷酶浓度顺序制作该标准色卡。 进一步地,该检测试剂盒还可包括β-半乳糖苷酶标准品。 在第二方面,本发明提供基于比率荧光法的β-半乳糖苷酶活力检测方法。 在本发明第二方面的一个实施方案中,该检测方法包括以下步骤: (1)提供包含β-半乳糖苷酶的样品; (2)使该样品与第一方面的β-半乳糖苷酶活力检测试剂盒中的反应试剂温育,以 进行酶促反应; (3)用480nm的激发波长激发酶促反应物以显示发射荧光颜色; (4)根据该发射荧光颜色判断该样品中β-半乳糖苷酶活力的大小,其中该发射荧 光颜色越偏红色,表明β-半乳糖苷酶活力越小,该发射荧光颜色越偏绿色,表明β-半乳糖苷 酶活力越大。 在本发明第二方面的另一个实施方案中,该检测方法包括以下步骤: (1)提供包含β-半乳糖苷酶的样品; (2)使该样品与第一方面的包括标准色卡的β-半乳糖苷酶活力检测试剂盒中的反 应试剂温育,以进行酶促反应; (3)用480nm的激发波长激发酶促反应物以显示发射荧光颜色; (4)将该发射荧光颜色与该β-半乳糖苷酶活力检测试剂盒中的标准色卡的颜色进 行比对,判断该样品中β-半乳糖苷酶活力的数值。 在本发明第二方面的又一个实施方案中,该检测方法包括以下步骤: (1)提供包含β-半乳糖苷酶的样品; (2)用第一方面的包括β-半乳糖苷酶标准品的β-半乳糖苷酶活力检测试剂盒中的 β-半乳糖苷酶标准品配制包含浓度为0、50、100、150、200、250、300、350、400、450、500U/L的 β-半乳糖苷酶的系列标准溶液; (3)使该样品和该系列标准溶液分别与该β-半乳糖苷酶活力检测试剂盒中的反应 试剂温育,以进行酶促反应; (4)用480nm激发波长分别激发各个酶促反应物,测量512nm发射波长发射的荧光 的强度与632nm发射波长发射的荧光的强度的比率,即F512/F632比率; (5)用该一系列标准溶液所得的F512/F632比率对相应的β-半乳糖苷酶浓度作图, 得到β-半乳糖苷酶活力标准曲线; (6)根据该样品所得的F512/F632比率,由该β-半乳糖苷酶活力标准曲线求出该样 品中β-半乳糖苷酶活力的数值。 在上述检测方法中,酶促反应的温度为30-40℃,时间为50-70分钟。优选地,酶促 5 CN 111593089 A 说 明 书 3/7 页 反应的温度为32℃,时间为60分钟。 上述基于比率荧光法的β-半乳糖苷酶活力检测试剂盒和检测方法可以在食品工 业领域、医疗诊断行业及生物科研领域检测β-半乳糖苷酶的活力。尤其是,上述检测方法可 以在β-半乳糖苷酶活力的非诊断性检测中应用。 本发明的有益效果: 本发明的β-半乳糖苷酶活力检测试剂盒和检测方法采用二-β-D-吡喃半乳糖苷 (FDG)作为β-半乳糖苷酶的底物,采用CdZnTeS量子点作为内置的荧光校正物。在β-半乳糖 苷酶的存在时,FDG的酶解产物荧光素产生绿色荧光,不同的β-半乳糖苷酶浓度产生的绿色 荧光强度不同,而CdZnTeS量子点产生固定强度的红色荧光,因此酶促反应体系所产生的荧 光颜色将为绿色荧光和红色荧光的荧光混合色。β-半乳糖苷酶浓度较低时,混合色偏向红 色;随着β-半乳糖苷酶浓度提高,荧光混合色逐渐变成橙色、黄色、浅黄色;β-半乳糖苷酶浓 度较高时,混合色偏向绿色。在包含β-半乳糖苷酶的待测样品的检测中,酶促反应后,根据 样品荧光混合色,可以判断待测样品中的β-半乳糖苷酶活力的大小;根据样品荧光混合色 并结合β-半乳糖苷酶活力标准色卡,可以判断待测样品中的β-半乳糖苷酶活力的数值;根 据样品荧光混合色并结合β-半乳糖苷酶活力标准曲线,可以得出待测样品中的β-半乳糖苷 酶活力的数值。由此,本发明开发了基于荧光比率的变化的β-半乳糖苷酶活力可视化检测 平台,能便捷地对待测样品中的β-半乳糖苷酶活力进行定性或定量检测。 附图说明 图1示意性地显示无荧光的二-β-D-吡喃半乳糖苷(FDG)在β-半乳糖苷酶(β-Gal) 酶促反应作用下,产生发绿色荧光的荧光素; 图2示意性地显示CdZnTeS量子点的制备; 图3显示CdZnTeS量子点的形貌,其中(A)显示CdZnTeS量子点的TEM图像,(B)显示 CdZnTeS量子点的尺寸分布; 图4是FDG和CdZnTeS量子点的混合溶液在添加或不添加β-半乳糖苷酶时的荧光光 谱和照片,显示了与不添加β-半乳糖苷酶时((-)β-Gal)相比,在添加β-半乳糖苷酶时(( ) β-Gal),酶促反应后512nm处的绿色荧光显著增加,而632nm处的红色荧光稳定; 图5显示β-半乳糖苷酶活力检测中,(A)反应温度对FDG的酶促反应产物荧光素分 子与CdZnTeS量子点的最高荧光强度比率(F512/F632)的影响,(B)反应时间对F512/F632比 率的影响; 图6显示β-半乳糖苷酶浓度对β-半乳糖苷酶活力检测的影响,其中(A)显示FDG和 CdZnTeS量子点的混合溶液在加入不同浓度的β-半乳糖苷酶时的荧光光谱,(B)显示β-半乳 糖苷酶浓度对F512/F632比率的标准曲线,表明在一定的β-半乳糖苷酶浓度范围内,β-半乳 糖苷酶浓度与F512/F632比率呈线性关系,误差条基于三次重复实验获得,激发波长480nm; 图7显示本发明的β-半乳糖苷酶荧光比率检测方法对β-半乳糖苷酶活力检测的选 择性,其中实验设置如下:不加任何酶的空白对照(1),β-半乳糖苷酶(2),及作为β-半乳糖 苷酶类似物的胰蛋白酶(3)、胃蛋白酶(4)、溶菌酶(5)、酪氨酸酶(6)、碱性磷酸酶(7)、葡萄 糖氧化酶(8)、乙酰胆碱酯酶(9),进行对比实验; 图8显示根据本发明实施例1,本发明的β-半乳糖苷酶比率荧光检测方法(A)和纯 6 CN 111593089 A 说 明 书 4/7 页 荧光检测方法(B)检测β-半乳糖苷酶的比较实验结果,其中β-半乳糖苷酶浓度从左到右分 别为0、25、100、250、750、1000、2000和2500U/L。












