技术摘要:
本公开文本的技术涉及热灭活的改良安卡拉牛痘(MVA)病毒(热iMVA)或热灭活的牛痘病毒作为疫苗免疫佐剂的用途。具体而言,本发明技术涉及热iMVA单独或与用作癌症免疫治疗剂的免疫检查点阻断(ICB)抗体组合作为癌症疫苗中肿瘤抗原的疫苗佐剂的用途。
背景技术:
提供了以下描述以帮助读者理解。所提供的信息或所引用的参考文献均不被承认 是本技术领域的现有技术。 恶性肿瘤固有地对常规疗法具有抗性,并且提出了重大的治疗挑战。免疫疗法是 一个不断发展的研究领域,并且是治疗某些类型的癌症的另外的选择。免疫疗法方法所基 于的基本原理是可以刺激免疫系统以识别肿瘤细胞,并且靶向它们进行破坏。尽管癌细胞 呈递抗原,并且存在可能对肿瘤细胞潜在发生反应的免疫细胞,但是在许多情况下,免疫系 统未被激活或肯定地被抑制。此现象的关键是肿瘤通过迫使免疫系统的细胞抑制免疫系统 的其他细胞来保护自身免受免疫应答影响的能力。肿瘤发展出许多免疫调节机制来逃避抗 肿瘤免疫应答。因此,需要改善的免疫治疗方法来增强宿主抗肿瘤免疫和靶向肿瘤细胞进 行破坏。
技术实现要素:
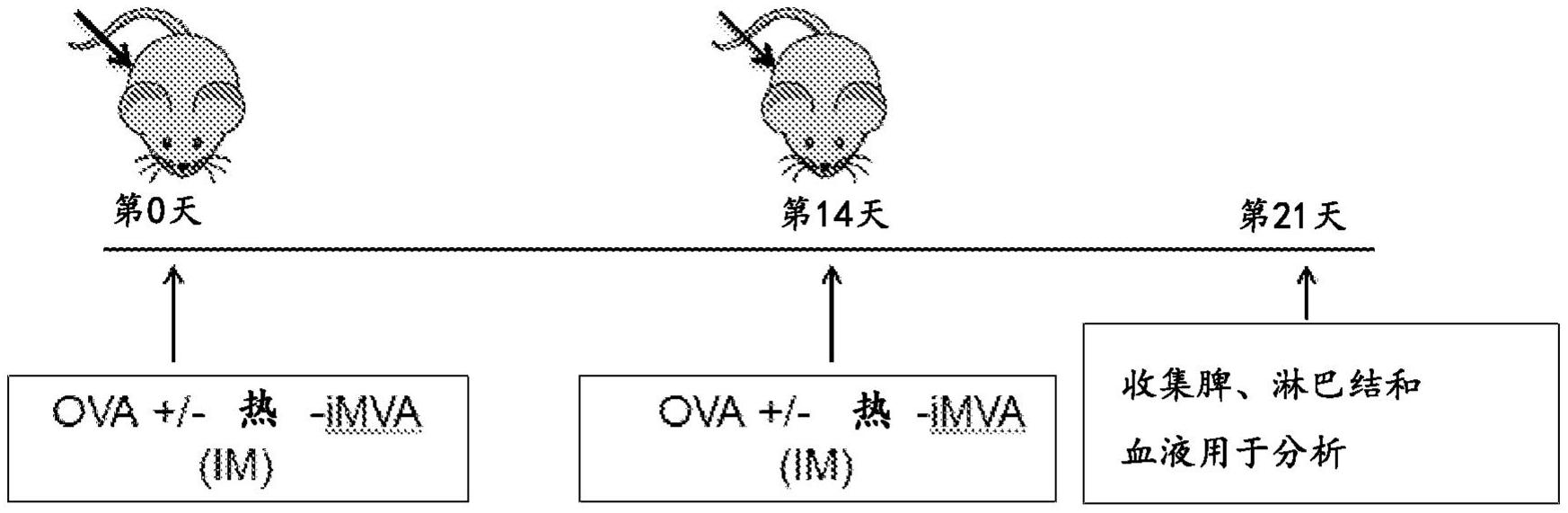
在一方面,本公开文本提供了一种在有需要的受试者中治疗实体瘤的方法,所述 方法包括向所述受试者给予包含抗原和治疗有效量的佐剂的免疫原性组合物,所述佐剂包 含灭活的改良安卡拉牛痘病毒和/或灭活的牛痘病毒。在一些实施方案中,所述灭活的改良 安卡拉牛痘病毒是热灭活的改良安卡拉牛痘病毒(热iMVA)或UV灭活的MVA,并且所述灭活 的牛痘病毒是热灭活的牛痘病毒或UV灭活的牛痘病毒。在一些实施方案中,所述灭活的改 良牛痘病毒是热iMVA。 在本文公开的方法的一些实施方案中,所述抗原选自肿瘤分化抗原、癌症睾丸抗 原、新抗原、在肿瘤与致癌病毒感染相关的情况下的病毒抗原、GPA33、HER2/neu、GD2、MAGE- 1、MAGE-3、BAGE、GAGE-1、GAGE-2、MUM-1、CDK4、N-乙酰葡糖胺转移酶、p15、gp75、β-连环蛋 白、ErbB2、癌症抗原125(CA-125)、癌胚抗原(CEA)、RAGE、MART(黑色素瘤抗原)、MUC-1、MUC- 2、MUC-3、MUC-4、MUC-5ac、MUC-16、MUC-17、酪氨酸酶、酪氨酸酶相关蛋白1和2、Pmel 17 (gp100)、GnT-V内含子V序列(N-乙酰葡糖胺转移酶V内含子V序列)、前列腺癌psm、PRAME(黑 色素瘤抗原)、β-连环蛋白、EBNA(爱泼斯坦-巴尔病毒核抗原)1-6、p53、kras、肺耐药蛋白 5 CN 111556760 A 说 明 书 2/25 页 (LRP)Bcl-2、前列腺特异性抗原(PSA)、Ki-67、CEACAM6、结肠特异性抗原-p(CSAp)、NY-ESO- 1、人乳头瘤病毒E6和E7及其组合。在一些实施方案中,所述抗原包含选自以下的新抗原: M 2 7 ( R E G V E L C P G N K Y E M R R H G T T H S L V I H D ) ( S E Q I D N O : 4 ) 、M 3 0 (PSKPSFQEFVDWENVSPELNSTDQPFL)(SEQ ID NO:5)、M48(SHCHWNDLAVIPAGVVHNWDFEPRKVS) (SEQ ID NO:6)及其组合。 在本文公开的方法的一些实施方案中,所述给予步骤包括以一个或多个剂量给予 所述免疫原性组合物。 在一些实施方案中,本文公开的方法进一步包括向受试者给予选自以下的免疫检 查点阻断剂:细胞毒性T淋巴细胞抗原4(CTLA-4)抑制剂、程序性死亡1(PD-1)抑制剂,PD-L1 抑制剂和PD-L2抑制剂。 在一些实施方案中,所述免疫原性组合物与所述免疫检查点阻断剂的给予分开、 依序或同时递送至受试者。 在一些实施方案中,所述PD-L1抑制剂是抗PD-L1抗体。 在一些实施方案中,治疗包含以下中的一种或多种:在所述受试者体内诱导针对 所述肿瘤的免疫应答或者在所述受试者体内增强或促进针对所述肿瘤的正在进行的免疫 应答、减小所述肿瘤的大小、根除所述肿瘤、抑制所述肿瘤的生长、抑制所述肿瘤的转移性 生长、诱导肿瘤细胞的凋亡或延长所述受试者的存活期。 在一些实施方案中,所述免疫应答的诱导、增强或促进包括以下中的一种或多种: 如与未处理的对照样品相比,干扰素γ(IFN-γ)在脾、引流淋巴结和/或血清中的T细胞中 表达水平增加;如与未处理的对照样品相比,抗原特异性T细胞在脾、引流淋巴结和/或血清 中水平增加;以及如与未处理的对照样品相比,抗原特异性免疫球蛋白在血清中水平增加。 在一些实施方案中,所述抗原特异性免疫球蛋白是IgG1或IgG2。 在一些实施方案中,将所述免疫原性组合物配制为肿瘤内、肌内、皮内或皮下给 予。 在一些实施方案中,所述肿瘤选自黑色素瘤、结直肠癌、乳腺癌、前列腺癌、肺癌、 胰腺癌、卵巢癌、皮肤鳞状细胞癌、默克尔细胞癌(Merkel cell carcinoma)、胃癌、肝癌和 肉瘤。 在一些实施方案中,所述灭活的改良安卡拉牛痘病毒或灭活的牛痘病毒以每次给 予约105至约1010噬斑形成单位(pfu)的剂量给予。 在本文公开的方法的一些实施方案中,所述受试者是人。 在一方面,本公开文本提供了一种包含抗原和佐剂的免疫原性组合物,所述佐剂 包含灭活的改良安卡拉牛痘病毒和/或灭活的牛痘病毒。在一些实施方案中,所述灭活的改 良安卡拉牛痘病毒是热灭活的改良安卡拉牛痘病毒(热iMVA)或UV灭活的MVA,并且所述灭 活的牛痘病毒是热灭活的牛痘病毒或UV灭活的牛痘病毒。在一些实施方案中,所述灭活的 改良牛痘病毒是热iMVA。 在一些实施方案中,本发明技术的免疫原性组合物还包含药学上可接受的载体。 在一些实施方案中,本发明技术的免疫原性组合物的抗原选自肿瘤分化抗原、癌 症睾丸抗原、新抗原、在肿瘤与致癌病毒感染相关的情况下的病毒抗原、GPA33、HER2/neu、 GD2、MAGE-1、MAGE-3、BAGE、GAGE-1、GAGE-2、MUM-1、CDK4、N-乙酰葡糖胺转移酶、p15、gp75、 6 CN 111556760 A 说 明 书 3/25 页 β-连环蛋白、ErbB2、癌症抗原125(CA-125)、癌胚抗原(CEA)、RAGE、MART(黑色素瘤抗原)、 MUC-1、MUC-2、MUC-3、MUC-4、MUC-5ac、MUC-16、MUC-17、酪氨酸酶、酪氨酸酶相关蛋白1和2、 Pmel 17(gp100)、GnT-V内含子V序列(N-乙酰葡糖胺转移酶V内含子V序列)、前列腺癌psm、 PRAME(黑色素瘤抗原)、β-连环蛋白、EBNA(爱泼斯坦-巴尔病毒核抗原)1-6、p53、kras、肺耐 药蛋白(LRP)Bcl-2、前列腺特异性抗原(PSA)、Ki-67、CEACAM6、结肠特异性抗原-p(CSAp)、 NY-ESO-1、人乳头瘤病毒E6和E7及其组合。在一些实施方案中,所述抗原包含选自以下的新 抗原 :M 2 7 ( R E G V E L C P G N K Y E M R R H G T T H S L V I H D ) ( S E Q I D N O : 4 ) 、M 3 0 (PSKPSFQEFVDWENVSPELNSTDQPFL)(SEQ ID NO:5)、M48(SHCHWNDLAVIPAGVVHNWDFEPRKVS) (SEQ ID NO:6)及其组合。 在一些实施方案中,本发明技术的免疫原性组合物进一步包含选自以下的免疫检 查点阻断剂:细胞毒性T淋巴细胞抗原4(CTLA-4)抑制剂、程序性死亡1(PD-1)抑制剂,PD-L1 抑制剂和PD-L2抑制剂。在一些实施方案中,所述PD-L1抑制剂是抗PD-L1抗体。 在本发明技术的免疫原性组合物一些实施方案中,灭活的改良安卡拉牛痘病毒或 灭活的牛痘病毒以每次给予约105至约1010噬斑形成单位(pfu)的剂量给予。 在一方面,本公开文本提供了一种试剂盒,其包含使用说明、容器器件和以下各项 的单独部分:(a)抗原;和(b)佐剂,所述佐剂包含灭活的改良安卡拉牛痘病毒和/或灭活的 牛痘病毒。在一些实施方案中,所述灭活的改良安卡拉牛痘病毒是热灭活的改良安卡拉牛 痘病毒(热iMVA)或UV灭活的MVA,并且所述灭活的牛痘病毒是热灭活的牛痘病毒或UV灭活 的牛痘病毒。在一些实施方案中,所述灭活的改良牛痘病毒是热iMVA。在一些实施方案中, 所述抗原选自肿瘤分化抗原、癌症睾丸抗原、新抗原、在肿瘤与致癌病毒感染相关的情况下 的病毒抗原、GPA33、HER2/neu、GD2、MAGE-1、MAGE-3、BAGE、GAGE-1、GAGE-2、MUM-1、CDK4、N- 乙酰葡糖胺转移酶、p15、gp75、β-连环蛋白、ErbB2、癌症抗原125(CA-125)、癌胚抗原(CEA)、 RAGE、MART(黑色素瘤抗原)、MUC-1、MUC-2、MUC-3、MUC-4、MUC-5ac、MUC-16、MUC-17、酪氨酸 酶、酪氨酸酶相关蛋白1和2、Pmel 17(gp100)、GnT-V内含子V序列(N-乙酰葡糖胺转移酶V内 含子V序列)、前列腺癌psm、PRAME(黑色素瘤抗原)、β-连环蛋白、EBNA(爱泼斯坦-巴尔病毒 核抗原)1-6、p53、肺耐药蛋白(LRP)Bcl-2、前列腺特异性抗原(PSA)、Ki-67、CEACAM6、结肠 特异性抗原-p(CSAp)、NY-ESO-1及其组合。在一些实施方案中,所述抗原包含选自以下的新 抗原 :M 2 7 ( R E G V E L C P G N K Y E M R R H G T T H S L V I H D ) ( S E Q I D N O : 4 ) 、M 3 0 (PSKPSFQEFVDWENVSPELNSTDQPFL)(SEQ ID NO:5)、M48(SHCHWNDLAVIPAGVVHNWDFEPRKVS) (SEQ ID NO:6)及其组合。在一些实施方案中,所述试剂盒进一步包含选自以下的免疫检查 点阻断剂:细胞毒性T淋巴细胞抗原4(CTLA-4)抑制剂、程序性死亡1(PD-1)抑制剂,PD-L1抑 制剂和PD-L2抑制剂。在一些实施方案中,所述免疫检查点阻断剂包含PD-L1抑制剂,所述 PD-L1抑制剂是抗PD-L1抗体。 附图说明 图1A-图1K是示出了在存在或不存在免疫佐剂热灭活的MVA(热iMVA)的情况下,将 C57BL/6J小鼠用鸡卵清蛋白(OVA)进行肌内(IM)疫苗接种后的抗原特异性T细胞和抗体应 答的一系列图。图1A:OVA肌内疫苗接种策略。在第0天和第14天,将小鼠用OVA(10μg/小鼠) /-热iMVA(107pfu/小鼠的当量)进行肌内注射。在第21天收集脾、淋巴结和血清。图1B和图 7 CN 111556760 A 说 明 书 4/25 页 1D:将脾细胞用OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激12h。通过流式细胞术 测量CD8 T细胞的IFN-γ的表达。图1D:在PBS、OVA或OVA 热iMVA疫苗接种的小鼠的脾中 IFN-γ CD8 T细胞的点状图。图1C和图1E:将脾细胞用OVA323-339(ISQAVHAAHAEINEAGR)肽 (SEQ ID NO:2)(10μg/ml)刺激12h。通过流式细胞术测量CD4 T细胞的IFN-γ的表达。图1E: 在PBS、OVA或OVA 热iMVA疫苗接种的小鼠的脾中IFN-γ CD4 T细胞的点状图。图1F和图1H: 将来自引流淋巴结(dLN)的细胞用OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激 12h。通过流式细胞术测量CD8 T细胞的IFN-γ的表达。图1G和图1I:将来自dLN的细胞用 OVA323-339(ISQAVHAAHAEINEAGR)肽(SEQ ID NO:2)(10μg/ml)刺激12h。通过流式细胞术测量 CD4 T细胞的IFN-γ的表达。图1J和图1K:通过ELISA确定PBS、OVA或OVA 热iMVA疫苗接种的 小鼠的血清中的OVA特异性免疫球蛋白G1(IgG1)或OVA特异性免疫球蛋白G2c(IgG2c)的效 价(*p<0.05;**p<0.01;***p<0.001;n=5)。 图2A-2G是示出了在C57BL/6J小鼠中,用OVA /-热iMVA或完全弗氏佐剂(CFA)进行 肌内(IM)或皮下(SC)疫苗接种后的抗原特异性T细胞和抗体应答的一系列图。图2A:OVA疫 苗接种策略。在第0天和第14天,将小鼠用OVA(10μg/小鼠) /-热iMVA(107pfu/小鼠的当量) 进行肌内或皮下注射。在第21天收集脾、淋巴结和血清。图2B:将脾细胞用OVA257-264 (SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激12h。通过流式细胞术测量CD8 T细胞的IFN-γ 的表达。图2C:将脾细胞用OVA323-339(ISQAVHAAHAEINEAGR)肽(SEQ ID NO:2)(10μg/ml)刺激 12h。通过流式细胞术测量CD4 T细胞的IFN-γ的表达。图2D:将来自dLN的细胞用OVA257-264 (SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激12h。通过流式细胞术测量CD8 T细胞的IFN-γ 的表达。图2E:将dLN用OVA323-339(ISQAVHAAHAEINEAGR)肽(SEQ ID NO:2)(10μg/ml)刺激 12h。通过流式细胞术测量CD4 T细胞的IFN-γ的表达。图2F和图2G:通过ELISA确定PBS、OVA 或OVA 热iMVA或OVA CFA疫苗接种的小鼠的血清中的OVA特异性免疫球蛋白G1(IgG1)或OVA 特异性免疫球蛋白G2c(IgG2c)的效价(*p<0.05;**p<0.01;***p<0.001;ns:不显著;n=5,PBS 组除外)。 图3A-3G是示出了在C57BL/6J、STINGGt/Gt和Batf3-/-小鼠中,用OVA /-热iMVA皮下 (SC)疫苗接种后的T细胞和抗体应答的一系列图。图3A:OVA疫苗接种策略。在第0天和第14 天,将小鼠用OVA(10μg/小鼠) 热iMVA(107pfu/小鼠的当量)进行皮下注射。在第21天收集 脾、淋巴结和血清。图3B:将脾细胞用OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺 激。通过流式细胞术测量CD8 T细胞的IFN-γ的表达。图3C:将脾细胞用OVA 3 2 3 - 3 3 9 (ISQAVHAAHAEINEAGR)肽(SEQ ID NO:2)(10μg/ml)刺激。通过流式细胞术测量CD4 T细胞的 IFN-γ的表达。图3D:将来自dLN的细胞用OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml) 刺激。通过流式细胞术测量CD8 T细胞的IFN-γ的表达。图3E:将来自dLN的细胞用OVA323-339 (ISQAVHAAHAEINEAGR)肽(SEQ ID NO:2)(10μg/ml)刺激。通过流式细胞术测量CD4 T细胞的 IFN-γ的表达。图3F和图3G:通过ELISA确定OVA 热iMVA疫苗接种的WT、STINGGt/Gt和Batf3-/- 小鼠的血清中的OVA特异性免疫球蛋白G1(IgG1)或OVA特异性免疫球蛋白G2c(IgG2c)的效 价(*p<0.05;**p<0.01;***p<0.001;ns:不显著;n=5,PBS组除外)。 图4A-图4C是示出了在C57BL/6J、STINGGt/Gt和Batf3-/-小鼠中,用MVA-OVA /-热 iMVA进行皮肤划痕疫苗接种后的T细胞和抗体应答的一系列图。图4A:MVA-OVA疫苗接种策 略。在第0天,在存在或不存在热iMVA(105pfu/小鼠的当量)的情况下,将C57BL/6J小鼠用不 8 CN 111556760 A 说 明 书 5/25 页 同剂量的MVA-OVA(105、106、107pfu/小鼠)进行疫苗接种。一周后,收获安乐死小鼠的脾、淋 巴结和血清。关于STINGGt/Gt和Batf3-/-小鼠,将它们用MVA-OVA(106pfu/小鼠)进行疫苗接 种。图4B:将脾细胞与MVA-OVA感染的BMDC共培养。通过流式细胞术测量CD8 T细胞的IFN-γ 的表达。图4C:将脾细胞与OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)脉冲处理的 BMDC共培养12h。通过流式细胞术测量CD8 T细胞的IFN-γ的表达。(*p<0.05;**p<0.01;ns: 不显著;n=5,PBS组除外)。 图5A-图5D是示出了热iMVA处理后GM-CSF培养的骨髓衍生的树突细胞(BMDC)的细 胞表面MHC-I(H-2Kb)表达及其摄取荧光标记的模型抗原OVA(OVA-647)的能力的一系列图。 图5A:将BMDC与OVA(1mg/ml) /-热iMVA(MOI为1)或聚IC(5μg/ml)一起孵育16h。然后,使用 抗H-2Kb抗体通过FACS确定细胞表面H-2Kb表达。图5B:示出了BMDC的H2-Kb的平均荧光强度。 图5C:将BMDC用热iMVA(MOI为1)感染1h并且然后与OVA-647(0.5mg/ml)一起孵育1h。通过流 式细胞术测量BMDC中吞噬的OVA-647的荧光强度。图5D:将BMDC与热iMVA(MOI为1)感染16h 并且然后与OVA-647(0.5mg/ml)一起孵育1h。通过流式细胞术确定BMDC中吞噬的OVA-647的 荧光强度。 图6A-图6B是示出了与用OVA /-热iMVA脉冲处理的GM-CSF培养的BMDC一起孵育 后,羧基荧光素乙酰乙酸琥珀酰亚胺酯(CFSE)标记的OT-I T细胞的增殖的一系列图。将 BMDC与OVA(0.1、0.2、0.5mg/ml) /-热iMVA(MOI为1)一起孵育3h,然后洗涤并且与CFSE标记 的OT-I细胞共培养3天(BMDC:OT-I T细胞=1:5)。将流式细胞术应用于测量OT-I细胞的 CFSE强度。图6A:与仅用OVA脉冲处理的BMDC一起孵育的OT-I T细胞的CFSE。图6B:与用OVA 和热iMVA脉冲处理的BMDC一起孵育的OT-1细胞的CFSE。 图7A-图7B是示出了与在存在或不存在热iMVA的情况下用OVA脉冲处理的GM-CSF 培养的BMDC一起孵育后,CFSE标记的OT-II T细胞的增殖的一系列图。将BMDC与OVA(0、0.1、 0.2、0.5mg/ml) /-热iMVA(MOI为1)或聚IC(5μg/ml)一起孵育3h,然后洗涤并且与CFSE标记 的OT-II细胞共培养3天(BMDC:OT-II T细胞=1:5)。将流式细胞术应用于测量OT-II细胞的 CFSE强度。图7A:与仅用OVA脉冲处理的BMDC一起孵育的OT-II T细胞的CFSE。图7B:与用OVA 热iMVA或聚IC脉冲处理的BMDC一起孵育的OT-I细胞的CFSE。 图8是示出了与在存在或不存在热iMVA的情况下用OVA脉冲处理的来自C57B/6J的 FMS样酪氨酸激酶3配体(Flt3L)培养的BMDC一起孵育后,CFSE标记的OT-I细胞的增殖的一 系列图。在存在Flt3L(100ng/ml)的情况下,将骨髓细胞在细胞培养基中分化9天。将Flt3L 培养的BMDC与OVA(0.01、0.03mg/ml) /-热iMVA(MOI为1)一起孵育3h,然后与CFSE标记的 OT-I细胞共培养3天(BMDC:OT-I=1:5)。将流式细胞术应用于测量OT-I细胞的CFSE强度。 图9A-图9C是示出了鼠pDC对于热iMVA引起的疫苗佐剂作用是重要的一系列图。图 9A:在存在或不存在pDC-耗尽抗体抗PDCA-1的情况下,用或不用热iMVA的OVA疫苗接种策 略。在第0天和第14天,将C57BL/6J小鼠用OVA(10μg/小鼠) /-热iMVA(107pfu/小鼠的当量) 进行皮内免疫。在第-1天、第1天、第13天和第15天,腹膜内给予选择性耗尽pDC的抗PDCA1抗 体(500μg/小鼠)或对照IgG(500μg/小鼠)。在第21天收集脾和淋巴结用于抗原特异性CD8 T 细胞分析。图9B:将脾细胞用OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激12h。通 过流式细胞术测量CD8 T细胞的IFN-γ的表达。图9C:将来自引流淋巴结(dLN)的细胞用 OVA257-264(SIINFEKL)肽(SEQ ID NO:1)(10μg/ml)刺激12h。通过流式细胞术测量CD8 T细胞 9 CN 111556760 A 说 明 书 6/25 页 的IFN-γ的表达(*p<0.05;***p<0.001;n=5,PBS组除外)。 图10A-图10D是示出了在引流淋巴结中不同树突细胞群体中的OVA-647摄取的一 系列图。图10A:将鼠腹股沟淋巴结进行消化并且获得单个细胞悬浮液并且将所述单个细胞 悬浮液用细胞表面标记来标记。将迁移性树突细胞群体标记为MHC-II CD11c 。将驻留树突 细胞标记为MHC-IIIntCD11c 。将迁移性树突细胞分为CD11b DC、Langerin-CD11b-DC和 Langerin DC。将Langerin DC分为两个群体:CD103 DC和朗格汉斯(Langerhans)细胞。驻留 树突细胞由两个群体构成:CD8α 驻留DC和CD8α-驻留DC。图10B:将C57/B6J小鼠通过皮内注 射用OVA-647(10μg/小鼠)进行疫苗接种。24h后,收获dLN,并且通过流式细胞术测量dLN的 不同的树突细胞群体中的OVA-647强度。图10C:将C57/B6小鼠通过皮内注射用OVA-647(10μ g/小鼠) 热iMVA(107pfu的当量)或Addavax(25μl/小鼠)进行疫苗接种。24h后,收获dLN,并 且通过流式细胞术测量dLN的CD103-CD11b-DC群体之间的OVA-647 细胞的百分比(**p<0.01; n=3)。图10D:通过流式细胞术测量dLN的CD11b DC之间的OVA-647 细胞的百分比(*p<0.05; n=3)。 图11A-图11D是示出了在治疗鼠B16-OVA肿瘤模型中,在存在或不存在佐剂和免疫 检查点阻断抗体抗PD-L1的情况下,辐照全细胞疫苗接种的功效的一系列图。图11A:在存在 或不存在抗PD-L1的情况下,用或不用热iMVA或聚IC的辐照B16-OVA疫苗接种策略。在 C57BL/6J小鼠的右侧腹皮内植入B16-OVA细胞(5x 104)。在第3、6和9天,在小鼠左侧腹用辐 照B16-OVA细胞(1x 106)在使用或不使用免疫佐剂热iMVA(107pfu/小鼠的)的情况下或在使 用TLR3激动剂聚IC(50μg/小鼠)的当量情况下进行皮内免疫,总共进行三次。在第3、6和9 天,向所指示的组腹膜内给予抗PD-L1抗体(200μg/小鼠)。监测小鼠的肿瘤大小和存活。图 11B和图11C:用PBS(n=5)、辐照B16-OVA(n=5)、辐照B16-OVA 热iMVA(n=5)、辐照B16-OVA 聚IC(n=5)、PBS 抗PD-L1(n=10)、辐照B16-OVA 抗PD-L1(n=10)、辐照B16-OVA 热iMVA 抗PD-L1(n=10)、辐照B16-OVA 聚IC 抗PD-L1(n=10)进行疫苗接种的荷瘤小鼠的Kaplan- Meier存活曲线**,p<0.01。图11D:肿瘤植入后数天内,不同治疗组的单独肿瘤体积。 图12A-图12C示出了在治疗疫苗接种肿瘤模型中,黑色素瘤新抗原肽与热iMVA的 共给予引起了抗肿瘤作用。图12A:疫苗接种模型。图12B和图12C:用黑色素瘤新抗原肽混合 物(M27/M30/M48)进行的皮下(SC)疫苗接种延迟了B16-F10肿瘤生长并且延长了小鼠的存 活。当新抗原肽混合物与热iMVA共给予时,增强了抗肿瘤作用。 图13示出了牛痘病毒株安卡拉(GenBank登录号:U94848.1;SEQ ID NO:3)的完整 的基因组序列。












