技术摘要:
本发明提供用于跨越生物膜递送药物的新颖的递送系统。本发明尤其提供包含所述递送系统的新颖的化学缀合物,用于合成所述化合物的方法,以及用于利用所述递送系统的方法,以用于在体外、离体和体内将遗传药物递送到组织和细胞中来用于医治各种医学病症。
背景技术:
“寡核苷酸药物”(OD)为包含核苷或核苷酸的序列的大分子药物。OD可有望为许多 医学病症带来革命性的医学医治。如本领域已知的,OD为单链或双链的、天然或修饰的RNA 或DNA分子或其组合。OD的实例尤其为siRNA(小干扰RNA),其为RNA诱导的沉默复合物 (RISC)的底物;作为Dicer核酸内切酶底物的siRNA序列(dsiRNA)、微小RNA(miRNA)、信使 RNA(mRNA)药物,或被设计成用作反义寡核苷酸(ASO)的DNA序列;所有这些都在靶标基因表 达的下调中有活性。 由于OD的大而重的带电结构,因此对于能够将OD跨越疏水性磷脂膜递送到细胞中 的递送系统存在未满足的需求。为了在临床环境中利用OD的目的,OD连接到递送系统的缀 合物的几个特征可为有利的,如在存在或不存在血浆蛋白的情况下的活性,或者包含对氧 化还原敏感的可裂解基团,所述可裂解基团在细胞外区室稳定但是在细胞质中占优势的还 原条件下经历有效裂解,从而使得货物药物(如OD)能够对细胞质靶标(如Dicer或RISC)发 挥其活性。
技术实现要素:
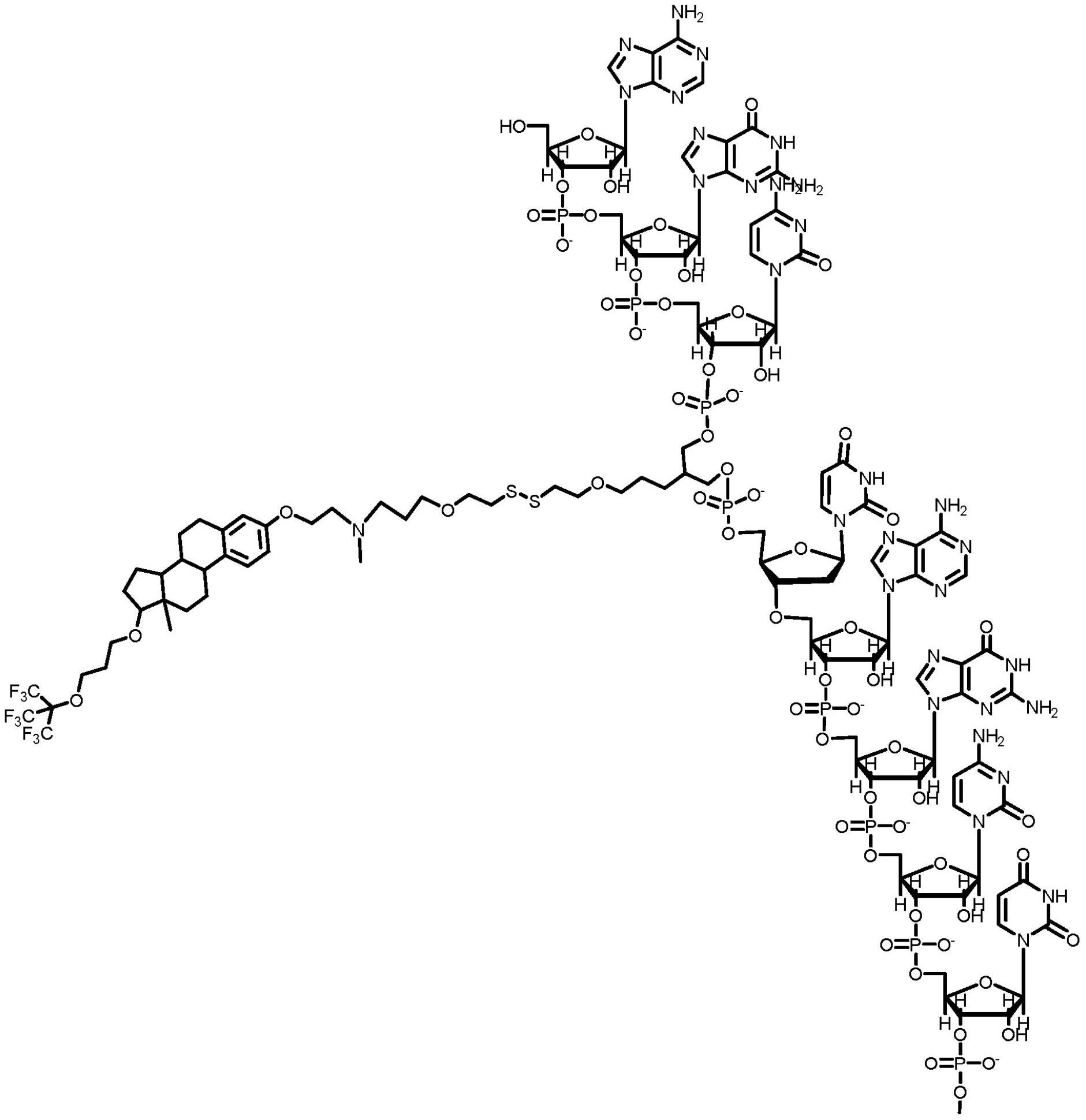
本发明基于新颖的分子递送系统(MDS),其为具有如式(II)中所阐述的结构的化 学部分,并且其在与货物药物如大分子OD缀合从而产生根据式(I)的缀合物时需要将OD跨 越磷脂膜递送到细胞中,在所述细胞中发挥其相应的生物活性,例如基因沉默。本发明基于 由发明人发现和开发的新颖的化合物,其使得能够克服大的和高电荷大分子药物跨越亲油 性细胞膜的巨大递送屏障。本发明提供MDS、包含其的缀合物,用于合成MDS和其缀合物的方 法,以及用于利用MDS的方法,以尤其用于在体外、离体和体内将遗传药物递送到组织和细 胞中,用于医治各种医学病症。 在本发明的一个实施例中,提供具有如式(I)中所阐述的结构的缀合物: 包括由如式(I)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶剂 化物和金属螯合物,以及盐的溶剂化物和水合物,其中: D为待跨越生物膜递送的选自由以下组成的组的药物(即,货物药物):小分子药 物、肽、蛋白质和OD(即,天然或修饰的单链或双链的DNA或RNA、siRNA、dsiRNA或ASO); 29 CN 111615404 A 说 明 书 2/103 页 y、z和w各自为独立地选自由以下组成的组的整数:0、1、2、3或4,其中如果y、z或w 中的任一个为0,那么这意味着相应的一个或多个E部分不存在;y、z或w中的至少一个不同 于0; E、E'或E”可相同或不同,各自独立地具有如通式(II)中所阐述的结构: 包括由如式(II)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶 剂化物和金属螯合物,以及盐的溶剂化物和水合物,其中: M1、M2、M3、M4各自分别选自由以下组成的组:N'、N”、不存在、醚、酰胺、酯、硫醚和硫 酯;其中N'和N”各自独立地选自由以下组成的组:-N(CH3)-、-NH-和-N(X)-;其中X为胺的保 护基团;M1、M2、M3、M4可相同或不同;N'、N”可相同或不同。 L为选自由以下组成的组的连接基:不存在、C1、C2、C3、C4、C5、C6亚烷基或杂亚烷基; 任选地被一个或多个氟原子或一个或多个羟基取代的C5或C6芳基或杂芳基;以及其组合; G1、G2、G3、G4各自独立地代表氢原子或甲基;G基团可相同或不同;G1、G2、G3或G4基团 中的至少两个为氢原子; a、b、c、d、e为各自独立地选自由以下组成的组的整数:0、1、2、3、4、5或6,其中0= 不存在;a、b、c、d、e可相同或不同; g代表选自以下的整数:0、1、2、3、4或5; W选自由以下组成的组:不存在、羟基、二羟基、酰胺、天然或修饰的核苷的残基、如 式(II1)、(II2)和(II3)中所阐述的结构中的任一个,以及其组合: 其中J选自由以下组成的组:不存在、-CH2-、仲胺或叔胺和氧; E、E'或E”可连接到由以下组成的组的任何部分:D;如本文所定义的保护基团(例 如,醇的保护基团);选自由以下组成的组的R或R'基团:氢、磷酸酯基团、硫酸酯基团或羧基 基团;和固体支撑物。在本发明的上下文中,E、E'或E”部分可经由一个或多个点连接到一个 D部分;并且W可同时连接到D和R或R'两者。 30 CN 111615404 A 说 明 书 3/103 页 在本发明的实施例中的一个中,g为0、1或2的整数。 在一个实施例中,c和d各自独立地代表1、2或3的整数;c和d可相同或不同。 在本发明的一个实施例中,G1、G2、G3、G4全部为氢原子。 在一个实施例中,L为二氟苄胺。 在另一个实施例中,X为胺的保护基团,TEOC[氨基甲酸2-(三甲基甲硅烷基)乙酯] 或Fmoc。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(V)中所阐述的结构: 包括由如式(V)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶剂 化物和金属螯合物,以及盐的溶剂化物和水合物;其中N'和N”各自独立地具有与式(II)中 定义的相同的含义。 在另一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有 如式(VII)中所阐述的结构: 包括由如式(VII)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶 剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中N'和N”各自独立地具有与式(II) 中定义的相同的含义。 在另一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有 如式(VIII)中所阐述的结构: 31 CN 111615404 A 说 明 书 4/103 页 包括由如式(VIII)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中N'具有与式(II)中相同的含义。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(VIII-H)中所阐述的结构: 包括由如式(VIII-H)中所阐述的结构表示的化合物的药学上可接受的盐、水合 物、溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在相关的实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有 如式(VIII-M)中所阐述的结构: 包括由如式(VIII-M)中所阐述的结构表示的化合物的药学上可接受的盐、水合 32 CN 111615404 A 说 明 书 5/103 页 物、溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在另一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有 如式(VIII-F)中所阐述的结构: 包括由如式(VIII-F)中所阐述的结构表示的化合物的药学上可接受的盐、水合 物、溶剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中X为胺的保护基团。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XIV)中所阐述的结构: 包括由如式(XIV)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶 剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中p和q各自独立地为0、1、2、3、4、5或 6的整数;N'具有与式(II)中相同的含义。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XIV-H)中所阐述的结构: 33 CN 111615404 A 说 明 书 6/103 页 包括由如式(XIV-H)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XIV-M)中所阐述的结构: 包括由如式(XIV-M)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XIV-F)中所阐述的结构: 包括由如式(XIV-F)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物,其中X为胺的保护基团。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中L部分为二氟苄 胺;并且因此,E、E'或E”各自具有如式(XV)中所阐述的结构: 包括由如式(XV)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶 34 CN 111615404 A 说 明 书 7/103 页 剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中N'具有与式(II)中相同的含义。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XV-H)中所阐述的结构: 包括由如式(XV-H)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XV-M)中所阐述的结构: 包括由如式(XV-M)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XV-F)中所阐述的结构: 包括由如式(XV-F)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 35 CN 111615404 A 说 明 书 8/103 页 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中X为胺的保护基团。 在另一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中L部分为四氟 苄胺;并且因此E、E'或E”各自具有如式(XVI)中所阐述的结构: 包括由如式(XVI)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、溶 剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中N'具有与式(II)中相同的意义。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XVI-H)中所阐述的结构: 包括由如式(XVI-H)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XVI-M)中所阐述的结构: 包括由如式(XVI-M)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 36 CN 111615404 A 说 明 书 9/103 页 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物。 在一个实施例中,本发明提供根据式(I)和式(II)的缀合物,其中E、E'或E”具有如 式(XVI-F)中所阐述的结构: 包括由如式(XVI-F)中所阐述的结构表示的化合物的药学上可接受的盐、水合物、 溶剂化物和金属螯合物,以及盐的溶剂化物和水合物;其中X为胺的保护基团。 本发明还提供前体分子,其为具有如式(II)、(III)、(IV)、(V)、(VI)、(VII)、 (VIII)、(VIII-H)、(VIII-M)、(IX)、(X)、(XI)、(XII)、(XIIa)、(XIII)、(XIIIa)、(XIV)、 (XIV-H)、(XIV-M)、(XV)、(XV-H)、(XV-M)、(XVI)、(XVI-H)、(XVI-M)中的任一个中所阐述的 结构的连接到醇的保护基团和/或胺的保护基团的本发明的任何一个或多个E、E'或E”部 分,其中所述保护基团意欲在分子的化学处理期间,例如在与寡核苷酸链缀合期间被除去。 本发明的一些实施例涉及用于在体外或体内将药物跨越生物膜递送到细胞中的 方法。所述方法包含使细胞与如本文所述的缀合物接触。 本发明的另一个实施例涉及用于医治有需要的患者的医学病症的方法;方法包含 向患者施用治疗有效量的药物组合物,所述药物组合物包含本发明的缀合物,所述缀合物 包括对于医治所述患者的疾病有用的药物D,以及药学上可接受的盐或载体。 还描述以非限制性方式说明本发明的实例,以便展示本发明的实施例可如何在实 践中进行。实例描述本发明的多种化合物和缀合物。所有描述的缀合物都根据式(Cn-1)或 (Cn-2),其各自包含具有根据通式(II)的结构的E、E'或E”部分。实例提供多种E、E'或E”部 分,它们表示如式(III)、(IV)、(V)、(VI)、(VII)、(VIII)、(VIII-H)、(VIII-M)、(IX)、(X)、 (XI)、(XII)、(XIIa)、(XIII)、(XIIIa)、(XIV)、(XIV-H)、(XIV-M)、(XV)、(XV-H)、(XV-M)、 (XVI)、(XVI-H)、(XVI-M)中所阐述的结构。与对照化合物相比,所有这些缀合物在基因沉默 中均表现出生物学性能,其可与上述化合物具有结构相似性,但是它们并不完全符合根据 式(II)的结构基序,并且分别不示出期望的生物活性。因此,由根据式(I)和(II)的本发明 的缀合物展示的性能曲线表示通用并且独特的结构框架,这使得其相关化合物能够用于将 大分子OD跨越磷脂膜递送到细胞中,从而在体外和体内表现出有用的生物活性。 另外,实例描述用于化学合成本发明的E部分、其前体以及将其组装成有用的缀合 物的方法。 附图说明 图1A和1B举例说明根据式(III)的本发明的E部分与寡核苷酸链的连接模式,以及 E部分的相应的氧化还原介导的裂解。图1A示出RNA链,其中根据式(III)的E部分连接在内 37 CN 111615404 A 说 明 书 10/103 页 部位置处;图1B举例说明在还原条件下,如在细胞质内占优势的那些条件下,根据式(III) 的此E部分的二硫化物基团的氧化还原介导的裂解,从而释放RNA药物。 图2A、2B、2C、2D和2E举例说明本发明的缀合物的作用机制(MOA),其中缀合物根据 式[Cn-2-(III)]。RNA双链体为25/27个核苷酸长的Dicer底物,具有连接在每条链的5'-末 端处的磷酸酯基团,并且其中位于内部的E部分的W基团根据式(II1),其中J为-CH2-;图2A展 示完整的缀合物;图2B展示在细胞质中占优势的还原条件下,E、E'和E”部分的裂解和除去, 为每个E、E'或E”部分留下短的残余残端;图2C展示RNA双链体与Dicer核酸内切酶的相互作 用,这导致双链断裂,留下21/21RNA双链体,并且除去E”部分的残端,留下连接在过客链的 5'-末端和内部位置处的E和E'的两个剩余残端;图2D展示通过解旋酶(即能够分离RNA链的 细胞质酶)除去有义(过客)链,同时除去连接到过客链的E和E'部分的剩余残端。因此,释放 完整的反义链,以进入RNA诱导的沉默复合物(RISC),以便诱导期望的基因沉默[图2E]。 图3A和3B描述本发明式[Cn-1-(IX)](即具有各自根据式(IX)的E和E'部分)的缀 合物在鼠模型中在体内静脉内施用时使ApoC3基因的表达沉默时的性能;(图3A) .肝脏中的 基因沉默;(图3B) .肾脏中的基因沉默。实验组为:(i) .媒剂:用于注射的含5%的葡萄糖的 水;(ii) .用于ApoC3的“裸”dsiRNA(在不附接分子纳米马达部分的情况下);(iii) .[Cn-1- (IX)]-Kras dsiRNA缀合物(非相关RNA序列,缀合到Apo-Si分子纳米马达递送系统);(iv) . 靶标[Cn-1-(IX)]-ApoC3 dsiRNA缀合物。 图4A和4B[Cn-2-(VIII)],即具有各自根据式(VIII)的E、E'和E”部分在体外使 EGFP基因的表达沉默时:(图4A):培养的Hela细胞;(图4B):培养的3T3细胞。呈现的为在0- 300nM的浓度范围的剂量-响应曲线。 图5描述本发明的两种缀合物:缀合物[Cn-1-(VIII-M)]和缀合物[Cn-2-(VIII- M)]在体外使3T3细胞中的EGFP基因的表达沉默时的生物学性能。观察到明显的剂量/响应, 具有高度显著的对数衰减,对两种细胞系用R2≈0.97曲线拟合。对于具有2个E部分的缀合 物[Cn-1-(VIII-M)](虚线),IC50发现为2.2nM,而对于具有3个E部分的缀合物[Cn-2-(VIII- M)](实线),IC50发现为0.8nM。












