技术摘要:
本公开尤其提供了包括腺苷A2A受体拮抗剂的微粉化药物颗粒的药物组合物以及使用所述药物组合物治疗癌症的方法。
背景技术:
免疫疗法的目标是驱动细胞毒性T细胞应答以根除癌症。为了防止对自身抗原的 反应,存在多个抑制性检查点信号。细胞外腺苷是在急性炎性过程期间由三磷酸腺苷通过 在多种组织类型的细胞表面上表达的外核苷酸酶CD73和CD39转化而产生的。腺苷通常响应 于如感染或缺血等刺激,通过与其在靶细胞上的细胞外G蛋白偶联受体结合而被上调以保 护宿主免受过度损伤,并开始愈合。然而,多种肿瘤类型可以主动地维持细胞外腺苷水平远 远超过急性期反应,以通过多种机制抑制宿主的免疫应答。恶性细胞在微环境中对腺苷的 增加将调节性T细胞募集到这一区域,并进一步提高腺苷水平。 癌症细胞似乎直接利用腺苷。因为,腺苷导致肿瘤抗原向适应性系统的呈递效率 较低,并且增强肿瘤生长。因此,已经设计了腺苷A2A受体拮抗剂,并且其正在临床开发中来 治疗癌症。因此,本领域需要能够提供商业药物产品所必须的暴露、安全和/或稳定性的理 想组合的腺苷A2A受体拮抗剂的调配物。为此,如本文所述,已经进行了开发例如生物利用 度改善的、在室温下稳定并且将胃刺激的可能性降到最低的此类调配物的研究。本公开针 对这些以及其它重要目的。
技术实现要素:
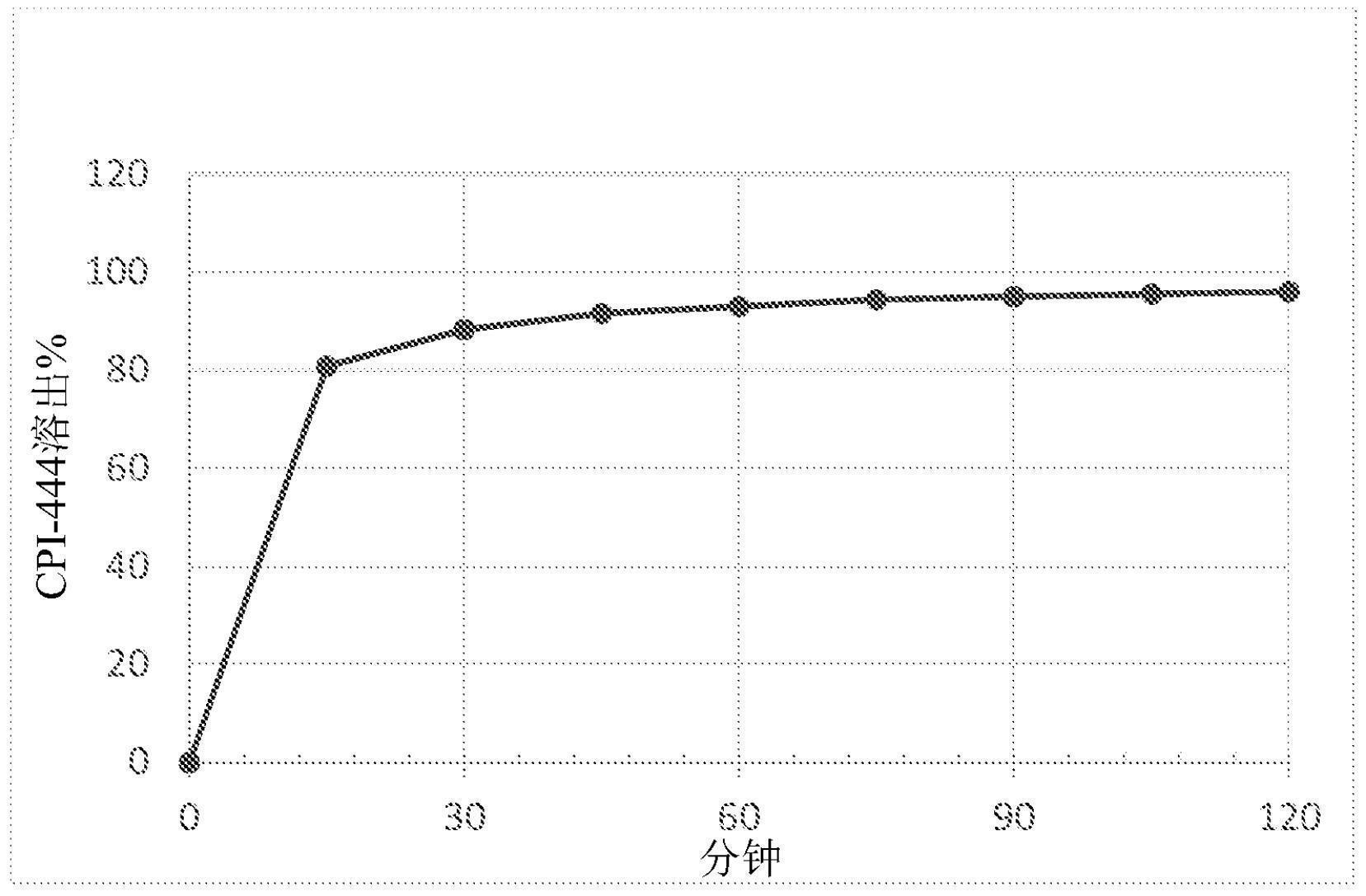
本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的药物组合物;其中所 述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述 微粉化药物颗粒具有D90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱 法测量的,所述微粉化药物颗粒具有D90为约20微米或更小的粒度分布。在一些方面,腺苷 A2A受体拮抗剂是式(I)化合物、式(II)化合物、式(III)化合物、式(IIIA)化合物、式(IIIB) 化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结 晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶 纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸 淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷 基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或 更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所 述药物组合物是片剂、胶囊或粉末的形式。在一些方面,所述药物组合物包括约10wt%到约 40wt%的腺苷A2A受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂 以及约1wt%到约20wt%的粘合剂。在一些方面,所述组合物包括约1mg到约1,000mg的腺苷 A2A受体拮抗剂。在一些方面,所述组合物具有外包衣。 本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的颗粒剂;其中所述微 14 CN 111615389 A 说 明 书 2/69 页 粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉 化药物颗粒具有D90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测 量的,所述微粉化药物颗粒具有D90为约20微米或更小的粒度分布。在一些方面,腺苷A2A受 体拮抗剂是式(I)化合物、式(II)化合物、式(III)化合物、式(IIIA)化合物、式(IIIB)化合 物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。 在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维 素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉 钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤 维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多 种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述颗 粒剂包括约10wt%到约40wt%的腺苷A2A受体拮抗剂、约40wt%到约80wt%的填料、约 1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,可以在所述颗 粒剂的内部或外部包含润滑剂、助流剂或表面活性剂。在一些方面,所述颗粒剂具有外包 衣。在一些方面,任选地具有外包衣的所述颗粒剂被压制成片剂,被置于胶囊壳内或被置于 小药囊或棒状包装内。 本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的片剂;其中所述微粉 化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化 药物颗粒具有D90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量 的,所述微粉化药物颗粒具有D90为约20微米或更小的粒度分布。在一些方面,腺苷A2A受体 拮抗剂是式(I)化合物、式(II)化合物、式(III)化合物、式(IIIA)化合物、式(IIIB)化合物 或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在 一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、 磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、 交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维 素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种 的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述片剂 包括约10wt%到约40wt%的腺苷A2A受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到 约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述片剂包括约1mg到 约600mg的腺苷A2A受体拮抗剂。在一些方面,所述片剂包含表面活性剂、助流剂、润滑剂或 其组合。在一些方面,所述片剂具有外包衣。 本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的粉末;其中所述微粉 化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化 药物颗粒具有D90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量 的,所述微粉化药物颗粒具有D90为约20微米或更小的粒度分布。在一些方面,腺苷A2A受体 拮抗剂是式(I)化合物、式(II)化合物、式(III)化合物、式(IIIA)化合物、式(IIIB)化合物 或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在 一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、 磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、 交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维 15 CN 111615389 A 说 明 书 3/69 页 素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种 的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述粉末 包括约10wt%到约40wt%的腺苷A2A受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到 约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述粉末包括约1mg到 约1,000mg的腺苷A2A受体拮抗剂。所述粉末可以以单剂量或多剂量使用,更常见地,其可以 乘以预期数量的剂量或剂型。在一些方面,所述粉末进一步包括表面活性剂、助流剂、润滑 剂或其中的两种或更多种的组合。在一些方面,所述粉末被压缩成片剂,置于胶囊壳内或置 于小药囊或棒状包装内。在一些方面,所述粉末被测量出并被直接施用或与食物或液体混 合。 本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的口服调配物;其中所 述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述 微粉化药物颗粒具有D90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱 法测量的,所述微粉化药物颗粒具有D90为约20微米或更小的粒度分布。在一些方面,腺苷 A2A受体拮抗剂是式(I)化合物、式(II)化合物、式(III)化合物、式(IIIA)化合物、式(IIIB) 化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结 晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶 纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸 淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷 基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或 更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所 述口服调配物是片剂、胶囊或粉末的形式。在一些方面,所述口服调配物包括约10wt%到约 40wt%的腺苷A2A受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂 以及约1wt%到约20wt%的粘合剂。在一些方面,所述口服调配物包括约1mg到约1,000mg的 腺苷A2A受体拮抗剂。在一些方面,所述口服调配物进一步包括表面活性剂、助流剂、润滑剂 或其中的两种或更多种的组合。在一些方面,所述口服调配物具有外包衣。 本文提供了包括惰性核和药物层的珠粒;其中所述外层包括微粉化药物颗粒和药 学上可接受的赋形剂;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过 激光衍射光谱法测量的,所述微粉化药物颗粒具有D90为约30微米或更小的粒度分布。在一 些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有D90为约20微米或更小的 粒度分布。在一些方面,腺苷A2A受体拮抗剂是式(I)化合物、式(II)化合物、式(III)化合 物、式(IIIA)化合物、式(IIIB)化合物或前述化合物之一的药学上可接受的盐。在一些方 面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填 料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解 剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种 的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚 乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或 更多种的组合。在一些方面,所述珠粒包括约10wt%到约40wt%的腺苷A2A受体拮抗剂、约 40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合 剂。在一些方面,所述珠粒进一步包括表面活性剂、助流剂、润滑剂或其中的两种或更多种 16 CN 111615389 A 说 明 书 4/69 页 的组合。在一些方面,所述珠粒具有外包衣。在一些方面,任选地具有外层包衣的所述珠粒 被压制成片剂,被置于胶囊壳内或被置于小药囊或棒状包装内。 本文提供的是在如羟丙甲纤维素胶囊壳等胶囊壳内包封有本文所述的药物组合 物、颗粒剂、粉末或珠粒的胶囊。在一些方面,胶囊壳包括肠溶聚合物。在一些方面,所述胶 囊具有外包衣。在一些方面,所述胶囊包括约1mg到约600mg的腺苷A2A受体拮抗剂。 本文提供了包括腺苷A2A受体拮抗剂(例如式(III)化合物)的药物组合物,其中, 如按照《美国药典(US Pharmacopeia(USP))》第<711>章的II型(桨式)溶出设备测量的, 所述组合物中的腺苷A2A受体拮抗剂的溶出度为在60分钟内至少70%。在一些方面,所述溶 出度为在60分钟内至少75%。在一些方面,所述溶出度为在60分钟内至少80%。在一些方 面,所述溶出度为在60分钟内至少85%。在一些方面,所述溶出度为在60分钟内至少90%。 在一些方面,所述溶出度为在10分钟内至少70%。在一些方面,所述溶出度为在10分钟内至 少60%。 本文提供了包括腺苷A2A受体拮抗剂(例如式(III)化合物)的药物组合物,如通过 美国药典(USP)第<701>章崩解测试通过激光衍射光谱法测量的,所述药物组合物对的崩 解时间为15分钟或更短。在一些方面,如通过激光衍射光谱法测量的,所述药物组合物具有 约15分钟或更短的崩解时间。在一些方面,如通过激光衍射光谱法测量的,所述药物组合物 具有约10分钟或更短的崩解时间。在一些方面,如通过激光衍射光谱法测量的,所述药物组 合物具有约5分钟或更短的崩解时间。 本文提供了通过施用治疗有效量的本文所述的用于治疗癌症的药物组合物、口服 调配物、片剂、胶囊、颗粒剂、粉末或珠粒来治疗患者的癌症的方法。在一些方面,所述癌症 是肺癌(例如,非小细胞肺癌)、黑色素瘤(例如,恶性黑色素瘤)、肾细胞癌、乳腺癌(例如,三 阴性乳腺癌)、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。在一些方面,将本文所述的药物组 合物、口服调配物、片剂、胶囊、颗粒剂、粉末或珠粒每天向患者施用一次(QD)。在一些方面, 每日一次施用可以包括施用1种、2种或3种口服调配物(例如,1种、2种或3种调配物或胶 囊)。在一些方面,将本文所述的药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末或珠粒 每天向患者施用两次(BID)。在一些方面,每日两次施用可以包括每日施用1种、2种或3种口 服调配物(例如,1种、2种或3种片剂或胶囊)两次。在一些方面,癌症治疗的所述治疗有效量 为每天约1mg到每天约1,000mg。在一些方面,用于成人癌症治疗的治疗有效量为每天约 50mg到约600mg。在一些方面,用于人类儿科或兽医应用中的癌症治疗的治疗有效量可以是 每天约5mg到约400mg。 本公开提供了通过将所述微粉化腺苷A2A受体拮抗剂与至少一种药学上可接受的 赋形剂混合形成颗粒剂来制备本文所述的药物组合物、口服调配物和颗粒剂的过程;将所 述颗粒剂干燥并研磨或过筛;以及将所述颗粒剂装入胶囊或将所述颗粒剂压制成片剂;以 及任选地将包衣涂覆到所述胶囊或片剂上。 本文描述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有 出乎意料的优异性质。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶 囊、颗粒剂、粉末、珠粒)具有出乎意料的优异生物利用度。在一些方面,本文所述的药物组 合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异稳定性。在 一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具 17 CN 111615389 A 说 明 书 5/69 页 有出乎意料的优异溶出曲线。在一些方面,本文所述的药物组合物和口服调配物(例如,片 剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异崩解曲线。在一些方面,本文所述的药物 组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异药代动力 学性质。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉 末、珠粒)具有出乎意料的优异的Cmin、Cmax、Cmax/Cmin比、Tmax或AUC。 本文阐述了本公开的这些方面和其它实施例和方面。 附图说明 图1示出了5号药物组合物《美国药典》(USP)<711>章溶出度测试中的溶出度,其 中将所述组合物于900mL约37℃的0.1N HCl溶出介质中置于桨速度为50rpm的USP设备2中。 图2是示出根据USP第<711>章溶出度测试1-3号药物组合物的溶出度的曲线图, 其中将所述组合物于900mL约37℃的0.1N HCl溶出介质中置于桨速度为50rpm的USP设备2 中。参考图2,P16K108003A是1号药物组合物;P16K108003B是2号药物组合物;并且 P16K108003C是3号药物组合物。 图3A-3C是曲线图,示出了根据USP第<711>章的溶出度测试,1-3号药物组合物 在900mL约37℃的0.1N HCl溶出介质中的作为在40℃和75%相对湿度下的储存时间的函数 的溶出度,在所述测试中,组合物置于桨速度为50rpm的USP设备2中。图3A示出了1号药物组 合物(P16K108003A)的溶出曲线。图3B示出了2号药物组合物(P16K108003B)的溶出曲线。图 3C示出了3号药物组合物(P16K108003C)的溶出曲线。 图4示出了根据USP第<711>章溶出度测试1号药物组合物在900mL约37℃且pH为 1.0的0.1N HCl溶出介质中的作为在加速条件(ACC)或受控室温条件(CRT)下的储存时间的 函数的溶出度,在所述测试中,组合物置于桨速度为50rpm的USP设备2中。 图5示出了根据USP第<711>章溶出度测试5号药物组合物在900mL约37℃且pH为 1.0的0.1N HCl溶出介质中的作为在加速条件(ACC)或受控室温条件(CRT)下的储存时间的 函数的溶出度,在所述测试中,组合物置于桨速度为50rpm的USP设备2中。












