技术摘要:
本发明提供一种基于数字PCR的HPV E6E7 mRNA检测试剂盒及使用其的检测方法,所述检测试剂盒包括如下组分:RNA抽提试剂、cDNA逆转录体系、数字PCR检测体系。其中,所述RNA抽提试剂包括如下组分:裂解液、去蛋白液、漂洗液、无RNA酶双蒸水、RNase‑Free吸附柱CR3。所述cDN 全部
背景技术:
传统PCR由于是大体积反应系统,非特异性的扩增增加了假阳性结果和背景信号, 因此,最终无法获得绝对定量的结果。数字PCR (dPCR)是近年来引起重视并迅速发展起来 的一种突破性的核酸定量分析技术。该技术先将核酸模板进行稀释,分配到大量独立的反 应单元中,使每个反应单元中只有单个模板分子,然后进行PCR扩增反应,扩增结束后对每 个反应室的荧光信号进行统计学分析,来定量 DNA拷贝数。数字PCR采用先扩增后定量,因 此不依赖扩增曲线的循环阈值(Ct),也无需采用内参基因和标准曲线,准确度高、重现性 好,可以实现绝对定量分析。
技术实现要素:
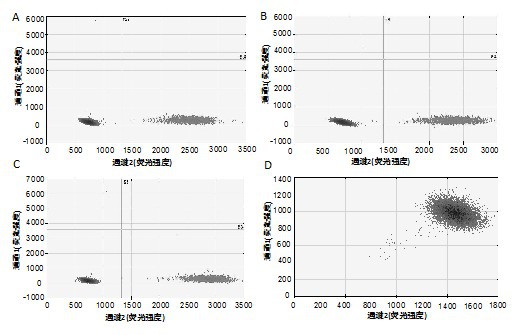
本发明要解决的技术问题是提供一种基于数字PCR的HPV E6E7 mRNA检测试剂盒 及使用其的检测方法,采用数字PCR技术极大减少了扩增后的背景荧光,显著提升检测通 量,提升检测浓度下限,极大提高检测精确性可以做到绝对定量。 为解决上述技术问题,本发明的实施例提供一种基于数字PCR 的HPV E6E7 mRNA 检测试剂盒,包括如下组分:RNA抽提试剂、 cDNA逆转录体系、数字PCR检测体系。 其中,所述RNA抽提试剂包括如下组分:裂解液、去蛋白液、漂洗液、无RNA酶双蒸 水、RNase-Free吸附柱CR3; 所述裂解液的组成浓度为:50mmol/L Tris-HCl、1.0mmol/L EDTA、 150mmol/L NaCl、0.1%SDS; 所述去蛋白液的组成浓度为:75%乙醇、10%tris edta、5%异丙醇、10%SDS; 所述漂洗液选用70%乙醇。 其中,所述cDNA逆转录体系包括如下组分:10×RT Mix、Super pure dNTPs(2.5mM each)、oligo-dT、Quant Reverse Transcriptase、 RNase-Free水。 其中,所述数字PCR检测体系按体积百分比包括如下组分: 4 CN 111575402 A 说 明 书 2/9 页 优选的,所述正向引物的工作浓度为20uM,终浓度为0.5uM;所述反向引物的工作 浓度为20uM,终浓度为0.5uM;所述HPV检测探针的工作浓度为10uM,终浓度为0.2uM;所述 Genotyping Mastermix的终浓度为1uM;所述Droplet Stabilizer的工作浓度为 25uM,终 浓度为1uM。 其中,所述数字PCR检测体系的pH范围为8.2-8.6。 所述数字PCR检测体系为HPV不同亚型基因标准品,具体如下表所示: 5 CN 111575402 A 说 明 书 3/9 页 本发明还提供一种使用上述的基于数字PCR的HPV E6E7 mRNA检测试剂盒的检测 方法,包括如下步骤: 6 CN 111575402 A 说 明 书 4/9 页 (1)标本RNA抽提制备 (1-1)将裂解液、去蛋白液混合均匀,匀浆样品在15-30℃,放置5min,使得核酸蛋 白复合物完全分离; (1-2)加入200μl氯仿,盖好管盖,剧烈震荡15sec,室温放置 3min; (1-3)4℃、12000rpm(~13400×g)离心10min,样品分成三层:黄色的有机相、中间 层和无色的水相,RNA在水相中,水相的体积约为所用裂解液试剂的50%,把水相转移到新 管中; (1-4)缓慢加入0.5倍体积无水乙醇,混匀(此时可能会出现沉淀),将得到溶液和 沉淀一起转入RNase-Free吸附柱CR3中,4℃、 12000rpm(~13400×g)离心30sec,若一次不 能将全部溶液和混合物加入RNase-Free吸附柱CR3中,分多次转入RNase-Free吸附柱CR3 中,4℃、12000rpm(~13400×g)离心30sec,弃掉收集管中的废液; (1-5)向RNase-Free吸附柱CR3中加入500μl漂洗液,4℃、 12000rpm(~13400×g) 离心30sec,弃废液,将CR3放入收集管中; (1-6)将RNase-Free吸附柱CR3转入一个新的1 .5ml离心管中,加入30-100μl RNase-Free ddH2O,室温放置2min,4℃、12000rpm (~13400×g)离心30sec,收集洗脱液 体; (2)逆转录cDNA (2-1)将模板RNA在冰上解冻;引物、10×RT mix解冻,解冻后迅速置于冰上,使用 前将每种溶液涡旋震荡混匀,简短离心以收集残留在管壁的液体; (2-2)按照下表的逆转录体系配制混合液,彻底混匀,涡旋振荡时间不超过5min, 离心后置于冰上; ; (2-3)37℃孵育60min; (3)阳性质控品和阴性对照品处理 阴性对照品和阳性质控品充分混匀,10000rpm离心后使用去离子水将阴性对照品 和阳性质控品分别稀释10倍,充分混匀,10000rpm 离心后备用待测; (4)将配制好的反应体系充分混匀,按32μl/管分装至1.5ml 灭菌尖底离心管内, 备用; (5)加样:在步骤(4)中准备的装有混合反应液的1.5ml灭菌尖底离心管内,分别加 入抽提后的标本模板8μl,或直接加入待测阴性对照品和阳性质控品各2μl(用去离子不足 体积至40μl),充分混匀,10000rpm离心后将1.5ml灭菌尖底离心管内混有模板的体系依次 7 CN 111575402 A 说 明 书 5/9 页 转移至source芯片的孔中; (6)液滴生成:利用 数字PCR液滴生成系统使反应体系在单个反应管 内生成八百万个油包水液滴; (7)PCR扩增 循环程序设置如下:50℃2min,95℃10min; 95℃15s→60℃1min,共45个循环; 98℃10min,1个循环; 最终冷却至12℃; 保存文件,运行; 在ABI热循环仪设定PCR循环第二步温度变化截率为0.5℃/min,其他为默认值; (8)反应完毕,存储结果以便进行数据处理; (9)液滴荧光信号读取; (10)结果判断:反应结束后自动保存检测数据文件,使用 RainDrop Analyst software II对结果进行分析,选择之前质粒结果作为模板进行设门,后对VIC和FAM通道同 时进行荧光补偿排除杂信号干扰。 本发明的上述技术方案的有益效果如下:本发明采用数字PCR 技术极大减少了扩 增后的背景荧光,显著提升检测通量,提升检测浓度下限,极大提高检测精确性可以做到绝 对定量。 附图说明 图1为本发明实施例一的检测结果图; 图2为本发明实施例二的检测结果图。












