技术摘要:
本发明提供了一种分泌表达重组前动力蛋白2(PK2)的生产方法,属于生物医药技术领域。本方法通过设计筛选出合适的引物,两次扩增目的基因以获取外源基因,通过对获取的外源基因进行重建载体构建使其适于表达,并通过挑取单克隆诱导做小量表达、用保存菌种做大量表达、以 全部
背景技术:
1999年,Mollay C等在蛙的皮肤分泌物中分离出了一种分子量约为8KD的富含半 胱氨酸残基的蛋白质,将其命名为Bv8。随后进一步的研究发现在哺乳类动物(如小鼠、大 鼠、猴子以及人类)中也有Bv8同源蛋白的存在,分别将它们命名为Prokineticin l(PKl)和 Prokineticin 2(PK2或Bv8)。其中PK2主要与其受体PKRs相结合,促进胃肠平滑肌的收缩, 调节细胞的增殖和存活。PKRs包括Prokineticin receptor 1(PKRl)和Prokineticin receptor2(PKR2),分别由位于染色体2ql4和20pl3区域上的PK0KR1和PK0KR2基因编码。 PKRl和PKR2都属于G蛋白偶联受体,两者的结构上髙度相似,差别主要是C端的序列有一定 的差异。PKRs与其配体结合后,能够通过与Gq蛋白相偶联升高细胞内钙离子浓度,影响细胞 内信号转导,参与机体多种生理过程。最初研究发现PK2可促进胃肠平滑肌的收缩,后来进 一步的研究发现PK2及PKRs在生殖系统、心血管系统以及中枢神经系统中都发挥病理生理 效应。在生殖系统中,PK2可促进睾丸血管生成,主要是通过磷酸化EKR1/2和Akt抑制血管内 皮细胞的凋亡。在心血管系统中,PK2在C57BL/6J小鼠心肌组织、H9c2细胞以及H5V细胞中都 有表达,而在终期充血性心力衰竭患者心脏中PK2的表达显著下调;进一步的研究还发现 PK2可通过PKRs激活EKR1/2和Akt信号通路促进血管生成,从而改善心脏功能和减轻心肌细 胞损伤。PKR1基因敲除小鼠的体重明显增加,出现糖尿病症状;敲除前脂肪细胞中PKR1则增 加其增殖和分化;而内皮特异性敲除PKR1的小鼠出现胰岛素抵抗,出现心脏和肾脏功能的 紊乱。PKR2转基因小鼠心功能虽然没有发生改变,但却出现心肌的异常肥大;在H5V血管内 皮细胞的研究中发现,PKR1基因下调可抑制PK2的促血管生成作用,而PKR2基因下调则对 PK2的促血管生成作用没有明显影响。在中枢神经系统中,PK2可抑制NMDA所致的皮层神经 元损伤,并可通过磷酸化EKR1/2和Akt减少低钾诱导的小脑颗粒细胞凋亡。在体外脑缺血模 型中发现,PK2可减轻氧糖剥夺所致的脑片损伤,这种保护作用也与EKR1/2和Akt通路有关。 在皮层神经元中发现,PK2能够增加AMPA受体介导的电流,并且通过PKC信号通路所介导。 PK2的发现对于治疗心脑血管相关疾病具有重要的作用,但目前现有的PK2生产工艺复杂, 并且价格昂贵,因此构建一套相对简单的P2K的生产工艺,并且具有活性且价格相对低廉 PK2蛋白对其临床应用具有重要的意义。
技术实现要素:
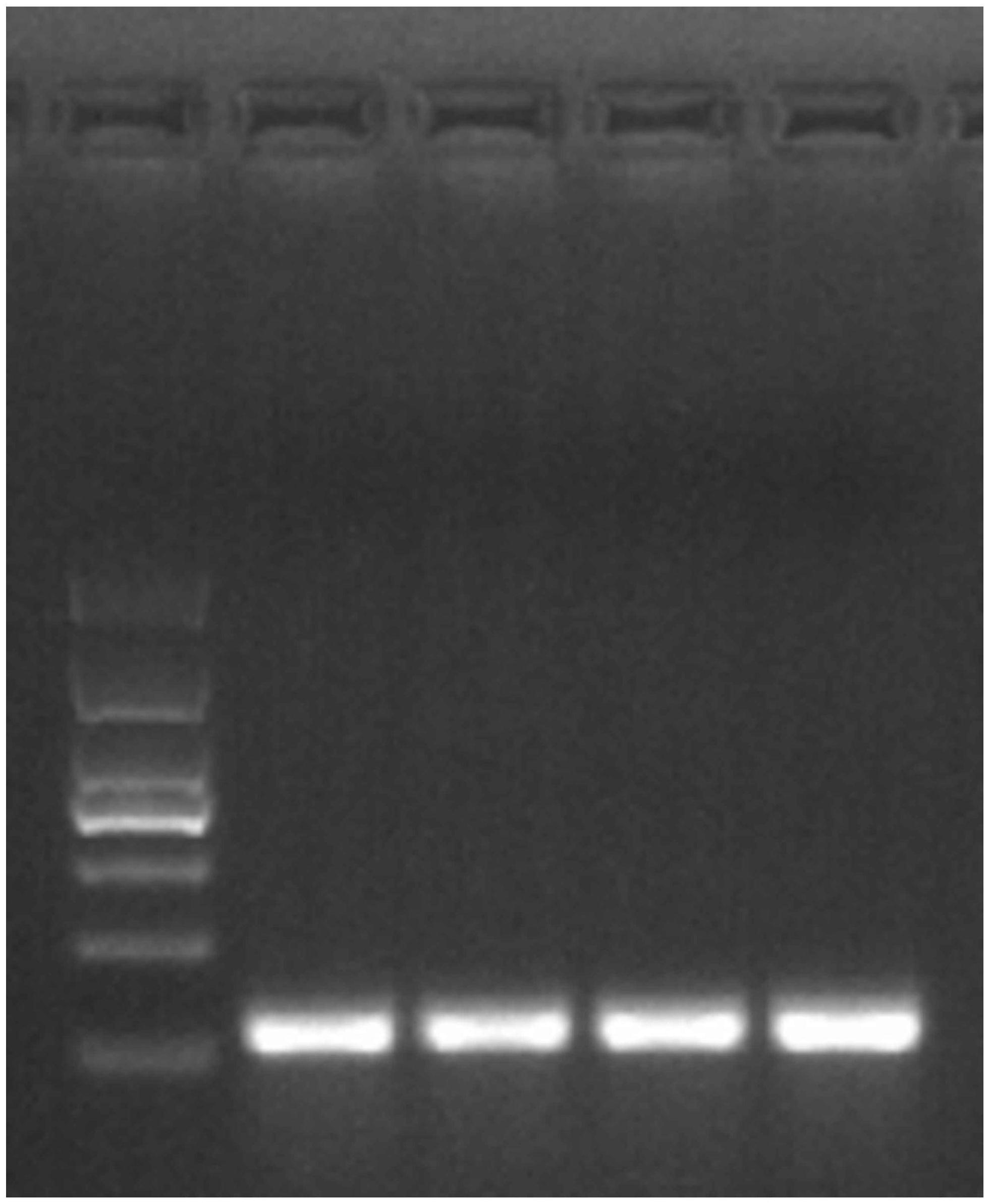
本发明的目的是针对现有的技术存在的上述问题,提供一种分泌表达重组前动力 蛋白2的生产方法,本发明所要解决的技术问题是如何生产动力蛋白2。 本发明的目的可通过下列技术方案来实现:一种分泌表达重组前动力蛋白2的生 产方法,其特征在于,本生产方法包括如下步骤: 1.获取外源基因: 4 CN 111575276 A 说 明 书 2/7 页 1 .1第一次扩增:使用无同源臂的引物进行凝胶电泳,根据片段大小配置1%-2% 的琼脂糖凝胶,电泳电压120V,电泳20min-30min即可,使用302nm波长的激发光激发核酸染 料,调整清晰度拍照记录并切胶回收;使用通用型胶回收试剂盒,切取DNA marker指示的目 的条带进行胶回收,最终洗脱时加入50ul EB溶液,无需测回收的cDNA片段浓度,直接用作 第二次扩增的模板; 1.2第二次扩增:再次PCR扩增目的基因,本次使用含同源臂的引物,具体步骤如第 一次扩增,扩增完再次胶回收。 2.重建载体构建: 2.1酶切载体:使用选定的限制性内切酶,37℃酶切3小时以上,胶回收载体; 2.2使用同源重组试剂盒进行无缝克隆; 2.3冷却连接产物的同时,将感受态细菌从-80冰箱取出,置于冰上使其融化; 2.4挑取单克隆摇菌提质粒测序; 2.5选取正确质粒转化表达菌;感受态为DE3,参数同DH5a。 3.蛋白表达纯化: 3.1挑取单克隆摇菌、保菌后诱导做小量表达 挑菌:用酒精灯灼烧冷却后的镊子夹取灭菌烘干的10ul移液器头,在平板上蘸取 单克隆菌落,将移液器头丢进15ml离心管,加入5ml LBkana液态培养基,以火略管口和管盖, 拧紧备用; 摇菌:倾斜插入摇床,37℃,220rpm,摇菌至OD值=0.6; 诱导:留取500ul菌液至1.5ml无菌离心管,4℃暂存,在剩余的15ml离心管中加入 4ul 2000×IPTG,继续摇菌4-6小时; 制样:转移15ml离心管至4℃离心机,水平转子,3900rpm,离心5-10min,弃干上层 培养基;用量程200ul的移液器吸取200ul Buf .B重悬菌沉淀,转移菌液至1.5ml离心管中, 加入50ul5×Loading Buf.,混匀;将1.5ml离心管置入沸水中,加热10-15min,后转移至-20 ℃冰箱冷却5min,取出,放入离心机,12000rpm离心5min;上样时吸取上层清液10ul,加入 1.5mm的蛋白胶,起初80V过浓缩胶,然后120V或以上继续电泳过分离胶; 转膜及染色:在300mA下转印160min,然后用丽春红染色10min,水洗: 采集:白光下观察、拍照。 3.2用保存菌种做大量表达 摇菌:将保存菌液加100ul到50ml无菌离心管中,再补充10ml-20ml LBkana液态培 养基,过夜; 扩菌:将过夜的菌液加入1L LBkana液态培养基中,37℃,220rpm,摇菌至OD值= 0.6; 诱导:加入400ul 2000×IPTG,继续摇菌4-6小时; 收菌:使用离心瓶在4℃下,以3860rpm的离心转速离心40min,收集菌液;倒掉上层 培养基,再加入5ml Buf.A,在振荡器上重悬菌液,然后吸至高速离心管,后配平。 3.3蛋白亲和纯化 破菌:根据菌沉淀量加入Buf.B 20ml-30ml,然后加入相应体积的溶菌酶(100×) 和PMSF(100×),先用超声探头将沉淀冲击混匀,后置入冰水中,保证冰足够;超声完将超速 5 CN 111575276 A 说 明 书 3/7 页 离心管放置于4℃冰箱,30min后取出配平;更换角转子10000rpm,4℃,离心20min;用巴氏管 吸出上清至新的50ml离心管中,置于冰上; 制柱:充分刷洗层析柱,并用ddH2O润洗一遍,塞入塑料垫,固定于铁架台,加入1ml Ni-NTA beads,用10倍体积的Buf.B去平衡该柱子; 加样:用吸管缓慢加入上清,避免飞溅,保证流速1.5s-1滴,直至全部流穿,用50ml 离心管接取流穿液; 洗杂:更换50ml离心管,缓慢加入Buf.C,保证流速,流穿3个柱子体积的Buf.C后, 用“Modified Bradford reagent”检测残留蛋白含量,若洗杂不充分继续流穿Buf.C,直至 变色不明显为止; 超滤:更换水平转子,在4℃下,以3860rpm超滤至残留200ul,后加入2ml灭菌0.9% NaCl重悬,后继续离心至200ul,再加入2ml灭菌0.9%NaCl重悬,继续离心至200ul,取出,加 入1ml灭菌0.9%NaCl重悬,用200ul移液器吸至离心管中即得目标蛋白; 检测浓度:使用BCA试剂盒检测纯化的蛋白浓度。 需要说明的是:本方法采用的外源引物的详情以核苷酸序列表的形式表述和公 开。 附图说明 图1是第二次PCR扩增目的基因回收的拍照图。 图2是白光下观察蛋白表达纯化的拍照图。












