技术摘要:
本发明公开了白喉毒素调控清除免疫细胞的CD45‑DTR转基因小鼠的构建方法与应用,通过酶切线性化BAC Clone CD45‑DTR,利用电穿孔法导入小鼠胚胎干细胞BALB/C ES细胞,得到插入IRES‑DTR至CD45外显子1位点的BALB/C ES细胞,随后将此BALB/C ES细胞通过囊胚注射法构建插入 全部
背景技术:
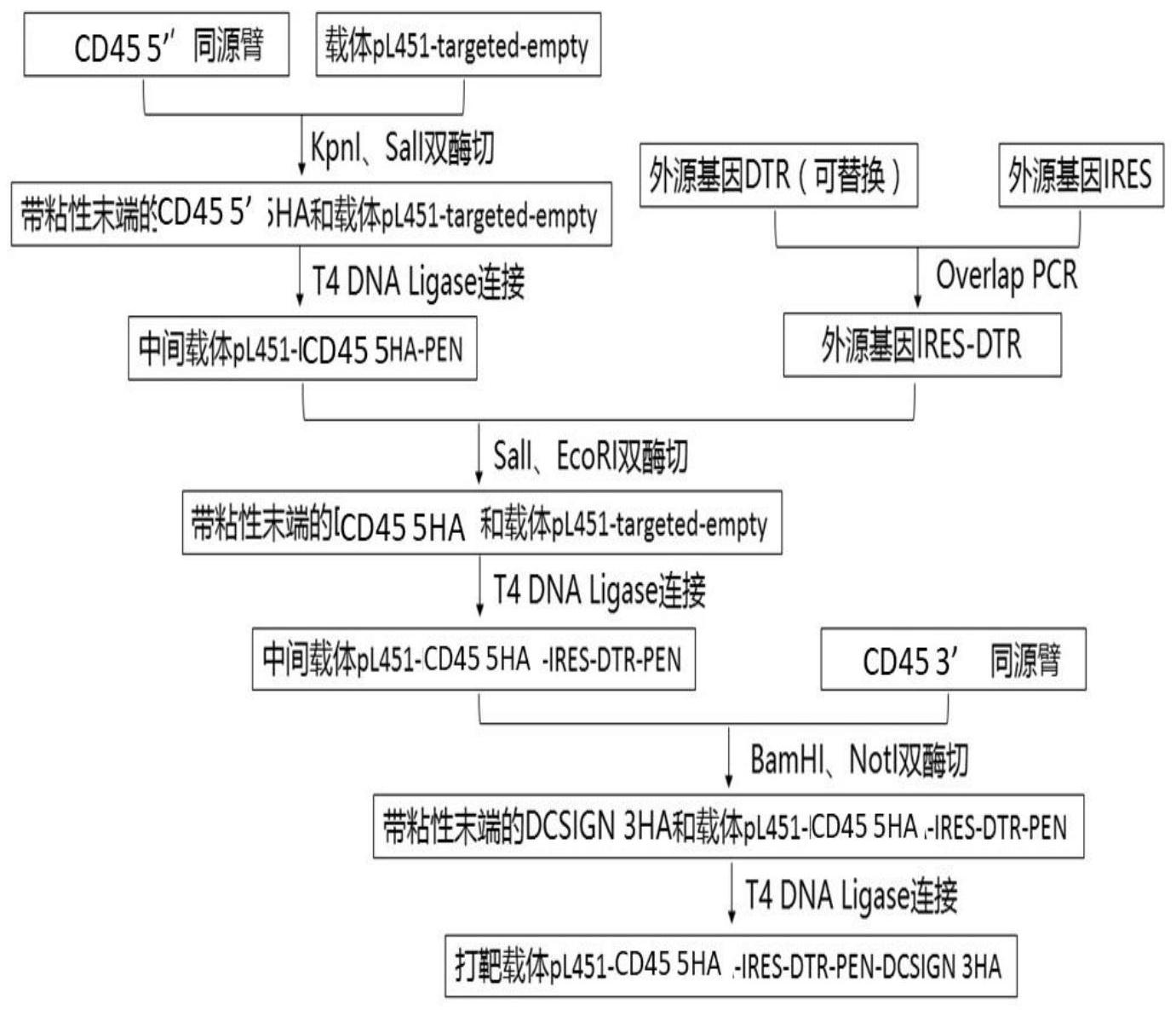
本发明所要解决的技术问题是为了克服现有的免疫细胞清除动物模型的不足,提 供一种新型可诱导的、选择性清除免疫细胞的小鼠模型的构建方法,CD45是一种特异性表 达于免疫细胞表面的信号分子,所以我们选择CD45作为驱动DTR表达的基因构建转基因小 鼠,这样在免疫细胞中会表达DTR,而不表达的组织中不表达DTR,注射合适剂量的DT就可以 选择性地诱导免疫细胞凋亡。 为了实现上述发明目的,本发明提供以下技术方案: 一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方法,包括以下步 骤: S1 .酶切线性化BAC Clone CD45-DTR载体(由本公司构建,具体构建过程见实施 例),利用电穿孔法导入小鼠胚胎干细胞BALB/C ES细胞,得到插入IRES-DTR至CD45外显子1 位点的BALB/C ES细胞; S2.利用插入IRES-DTR至CD45外显子1位点的BALB/C ES细胞,囊胚注射法构建插 入IRES-DTR至CD45外显子1位点的CD45-DTR转基因小鼠。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法,所述步骤S1具体包括以下步骤: (1)小鼠胚胎成纤维细胞用MEF培养基培养,经30Grayγ射线灭活处理后作为滋养 层细胞。BALB/C ES细胞(以下简述为ES细胞)种在滋养层细胞上,用ES培养基培养; (2)电穿孔法将利用PI-SceI酶切线性化的打靶载体BAC Clone CD45-DTR转入ES 4 CN 111607614 A 说 明 书 2/9 页 细胞,使BAC Clone CD45-DTR整合至基因组中; (3)利用G418阳选,挑选得到插入BAC Clone CD45-DTR的BALB/C ES细胞克隆; (4)提取ES细胞基因组DNA为模板,进行PCR鉴定。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法,所述步骤S1中的步骤4具体为: 提取ES细胞基因组DNA为模板,利用序列为SEQ ID NO.17的正向引物和序列为SEQ ID NO .18的反向引物进行PCR鉴定,插入BAC Clone CD45-DTR的ES细胞阳性克隆可见约 4.1kb条带。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法,所述步骤S2具体包括以下步骤: (1)插入BAC Clone CD45-DTRBALB/C ES细胞注射入C57BL/6J囊胚,再接种到假孕 的KM母鼠子宫中,出生得到毛色为黑色和白色混杂嵌合体小鼠; (2)提取转基因小鼠鼠尾DNA作为模板,PCR鉴定。 (3)利用白色占比最高的5只雄性转基因嵌合体小鼠F0与BALB/c雌鼠交配,得到毛 色为白色的小鼠可能为DC SIGN-DTR转基因杂合小鼠。小白鼠经鼠尾PCR鉴定后得到DC SIGN-DTR转基因杂合小鼠,即为F1代小鼠,鼠尾PCR鉴定方法同步骤2。 (4)F1代小鼠与C57BL/6J母鼠杂交进行传代、培育,同时对所得的子代小鼠进行鼠 尾PCR鉴定,鉴定方法同步骤2,得到F2代小鼠。按相同方法对小鼠进行传代。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法,所述步骤S2中的步骤2具体为: 提取转基因小鼠鼠尾DNA作为模板,利用序列为SEQ ID NO.19的正向引物和序列 为SEQ ID NO.20的反向引物作PCR鉴定,带有IRES-DTR的阳性小鼠可见约1.2kb条带。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法在在研究免疫细胞功能方面的应用。 进一步的,上述一种白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方 法在制备人源化小鼠方面的应用。 进一步的,如上述白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方法 建立清除免疫细胞小鼠模型的方法,包括以下步骤:在第1、第2、第4、第7天分别腹腔注射DT (20ng/g),特异性清除小鼠免疫细胞,建立清除免疫细胞小鼠模型。 进一步的,对上述建立清除免疫细胞小鼠模型的方法的验证方案,所述验证方案 包括以下步骤:获取小鼠组织,制备成单细胞悬液,用Fc blocker封闭Fc受体后,利用CD45、 F4/80、CD11b流式抗体染色。 进一步的,对上述建立清除免疫细胞小鼠模型的方法的验证方案,具体包括:获取 小鼠表皮,制备成单细胞悬液,用2%FCS-PBS重悬细胞,经Fc blocker封闭Fc受体后,利用 anti-mouse-CD45流式抗体染色,染色完毕洗去多余抗体,单细胞悬液用流式细胞仪上机检 测。 综合上述技术方案,本发明公开了一种白喉毒素调控清除免疫细胞的CD45-DTR转 基因小鼠的构建方法与应用,至少有以下方面的有益效果: (1)本发明克服了现有免疫细胞清除动物模型的不足,提供了一种能稳定传代的 5 CN 111607614 A 说 明 书 3/9 页 新型可诱导型的、白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠动物模型的制备、使 用和检测方法。 (2)本发明建立了一种高效、安全靶向整合外源基因至小鼠胚胎干细胞基因组 CD45外显子1位点的方法,并证实敲入的外源基因表达正常。 (3)本发明提供了筛选与鉴定阳性细胞株/克隆的方法和应用实例。 (4)本发明提供了利用转基因ES细胞生产和培育转基因小鼠的方法和应用实例。 (5)本发明构建得到的白喉毒素调控清除免疫的CD45-DTR转基因小鼠动物模型, 免疫细胞清除效率达80%-90%,能够较好地清除免疫细胞,且在不用白喉毒素诱导时,免 疫细胞功能不受影响,利用白喉毒素诱导清除免疫细胞时无副反应,提供了一种全新的免 疫细胞清除的原理和方法,提供了一种全新的免疫细胞可诱导清除的动物模型,可以用于 免疫细胞的研究以及形成人源化小鼠。 附图说明 图1:构建靶向小鼠CD45的打靶质粒流程示意图; 图2:携带抗性基因Neomycin的空载体pL451-targeted-empty的质粒结构示意图; 图3:携带外源基因IRES-DTR、抗性基因Neomycin和CD45两侧同源臂的打靶载体 PL451-loxP IRES-DTR CD45 3HA 5HA质粒结构示意图; 图4:打靶载体打靶原理示意图; 图5:PCR筛选与鉴定靶向CD45外显子1位点的DC-SIGN BAC单克隆,正确靶向的单 克隆出现约1.4kb条带; 图6:PCR筛选与鉴定插入CD45-DTR外显子1位点的小鼠胚胎干细胞单克隆,正确插 入的单克隆细胞出现约1.4kb条带; 图7:利用插入CD45-DTR的ES细胞培育CD45-DTR转基因小鼠流程图; 图8:CD45-DTR转基因小鼠(F1)PCR鉴定结果图; 图9:CD45-DTR转基因小鼠腹腔注射DT特异性清除小鼠免疫细胞的流式细胞术检 测敲除效率结果图。
技术实现要素:
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终 相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附 图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。 实施例1 BAC Clone CD45-DTR载体的构建。 (1)构建靶向整合外源基因至小鼠CD45外显子1位点的打靶载体,流程如附图1所 示: 从genome .ucsc .edu网站检索并下载获得小鼠CD45基因组序列,结合小鼠CD45 (Genbank No:NM_001111316.2)序列,确定各外显子和内含子位置及序列。包含整个CD45基 因的BAC Clone:RP23-180D23从Children’hospotal Oakland Research Institute购买获 得,BAC DNA利用 HiPure Plasmid Filter Maxiprep Kit(Invitrogen)制备备 6 CN 111607614 A 说 明 书 4/9 页 用。 PCR扩增得目的基因片段CD45 5’侧同源臂(CD45 5HA):以RP23-180D23 BAC DNA 为模板,利用正向引物CD45-5HA-F(KpnI)-ACCACCGGTACCGTGCAAAGTATGCGTTCTTTTCTTTTAG (SEQ ID NO.1),反向引物CD45-5HA-R(SalI)-AACAACGTCGAC ATCTGGAGATCAGCTGTGCCC(SEQ ID NO.2)作PCR扩增5’侧同源臂5HA(SEQ ID NO.3)。下划线序列为酶切位点。 表1:PCR反应体系 表2:PCR扩增条件: 将目的基因片段CD45 5HA克隆至带阳性选择标记基因的载体pL451-targeted- empty,载体结构如附图2所示:PCR产物经琼脂糖凝胶电泳分离后,分别切出目的条带并利 用AxyPrep DNA Gel Extraction Kit(Axygen)回收。带Neomycin阳性选择标记的载体 pL451-targeted-empty(counter-Selection BAC Modification Kit,Genebridges)和回 收后的CD45 5HA经KpnI、SalI(NEB)双酶切。酶切的PCR产物经AxyPrep PCR Clean-Up Kit (Axygen)纯化回收,酶切的载体经琼脂糖凝胶电泳分离后切出目的条带并利用AxyPrep DNA Gel Extraction Kit(Axygen)回收。利用T4 DNA ligase(NEB)将载体与目的片段连 接,接着转化至大肠杆菌DH5α,挑取单个菌落培养,提取质粒DNA,经酶切初步鉴定后送商业 公司测序。测序结果显示CD45 5HA插入成功并命名为中间载体pL451-CD45 5HA-PEN。 PCR扩增得目的基因片段IRES和DTR:以pLVX-EF1α-IRES-mCherry质粒(addgene) 为模板,利用正向引物IRES-F(SalI)-ACCACCGTCGACGCCCCTCTCCCTCCCCCC(SEQ ID NO.4), 反向引物IRES-R-CATGGTTGTGGCAAGCTTATCATCGTG(SEQ ID NO.5)作PCR扩增基因片段IRES (SEQ ID NO .6);以pIRES-proHB EGF WT质粒(addgene)为模板,利用正向引物DTR-F- CACGATGATAAGCTT GCCACAACCATGAAGCTGCTGCCGTCG(SEQ ID NO .7),反向引物DTR-R (EcoRI)-ACCACCGAATTCTTAGTGGGAATTAGTCATGCCC(SEQ ID NO .8)作PCR扩增DTR(SEQ ID NO.9)。下划线序列为酶切位点。PCR反应体系见表1,PCR扩增条件见表2。 PCR产物经琼脂糖凝胶电泳分离后,分别切出目的条带并利用AxyPrep DNA Gel Extraction Kit(Axygen)回收。IRES和DTR进行Overlap PCR,合成融合基因片段IRES-DTR (SEQ ID NO.10),具体条件如表3和表4: 表3:Overlap PCR反应体系: 7 CN 111607614 A 说 明 书 5/9 页 表4:Overlap PCR扩增条:: 将目的基因片段IRES-DTR克隆至中间载体pL451-CD45 5HA-PEN:PCR产物经琼脂 糖凝胶电泳分离后,分别切出目的条带并利用AxyPrep DNA Gel Extraction Kit(Axygen) 回收。纯化后的IRES-DTR和中间载体pL451-DCSIGN 5HA-PEN分别经SalI、EcoRI(NEB)双酶 切。酶切的PCR产物经AxyPrep PCR Clean-Up Kit(Axygen)纯化回收,酶切的质粒载体经琼 脂糖凝胶电泳分离后切出目的条带并利用AxyPrep DNA Gel Extraction Kit(Axygen)回 收。利用T4 DNA ligase(NEB)将载体与目的片段连接,接着转化大肠杆菌DH5α,挑取单个菌 落培养,提取质粒DNA,经酶切初步鉴定后送商业公司测序。测序结果显示IRES-DTR插入成 功并命名为中间载体pL451-CD45 5HA-IRES-DTR-PEN。 PCR扩增目的基因片段CD45 3’侧同源臂(CD45 3HA):以RP23-180D23 BAC DNA为 模板,利用正向引物CD45-3HA-F(BamHI)-ACCACCGGATCCACCATGGGTTTGTGGCTCAAAC(SEQ ID N O . 1 1 ) ,反 向 引 物 D C - S I G N - 3 H A - R ( N o t I ) - A C C A C C G C G G C C G C ATCCATCACACGCAACTTTTAAAAATAG(SEQ ID NO.12)作PCR扩增3’侧同源臂CD45 3HA(SEQ ID NO.13)。下划线序列为酶切位点。PCR反应体系见表1,PCR扩增条件见表2。 将目的基因片段CD45 3HA克隆至中间载体pL451-CD45 5HA-IRES-DTR-PEN:PCR产 物经琼脂糖凝胶电泳分离后,分别切出目的条带并利用AxyPrep DNA Gel Extraction Kit (Axygen)回收。纯化后的CD45 3HA和中间载体pL451-CD45 5HA-IRES-DTR-PEN分别经 BamHI、(NEB)双酶切。酶切的PCR产物经AxyPrep PCR Clean-Up Kit(Axygen)纯化回收,酶 切的质粒载体经琼脂糖凝胶电泳分离后切出目的条带并利用AxyPrep DNA Gel Extraction Kit(Axygen)回收。利用T4 DNA ligase(NEB)将载体与目的片段连接,接着转 化大肠杆菌DH5α,挑取单个菌落培养,提取质粒DNA,经酶切初步鉴定后送商业公司测序。测 序结果显示CD45 3HA插入成功并命名为打靶载体PL451-loxP IRES-DTR CD45 3HA 5HA,载 体结构见附图3所示,序列如SEQ ID NO.14所示。至此靶向整合外源基因至小鼠CD45外显子 8 CN 111607614 A 说 明 书 6/9 页 1位点的打靶质粒构建完成。 利用打靶载体靶向整合外源基因至小鼠CD45 BAC: (2)电穿孔法将pRed/ET转化入包含整个CD45基因的大肠杆菌BAC Clone RP23- 180D23:将包含整个CD45基因的大肠杆菌BAC Clone RP23-180D23接种于含氯霉素(15μg/ mL)的LB平板,37℃培养16h。挑选1个克隆于有1mL LB培养基(含15μg/mL氯霉素)的2mL离心 管(盖子上戳一个洞使能够通气),37℃200rpm培养过夜。取30μL培养过夜的大肠杆菌克隆 于有1.4mL LB培养基(含15μg/mL氯霉素)的2mL离心管,37℃1000rpm,培养2-3h扩增得对数 期的大肠杆菌。扩增的大肠杆菌2℃11000rpm离心30s,吸弃上清。大肠杆菌沉淀用1mL冰上 预冷的ddH20清洗3遍,最后留下约30μL ddH2O重悬大肠杆菌,加入1μL pRed/ET(20ng/μL, counter-Selection BAC Modification Kit(Genebridges,USA)),轻弹混匀,冰上静置。转 移大肠杆菌悬液至冰上预冷的1mm电穿孔管,利用 Electroporator 2510进行 电穿孔,1350V 10μF 600 Ohms,将pRed/ET转化入BAC Clone RP23-180D23。用1mL无抗生素 LB培养基重悬大肠杆菌并转移至2mL离心管,30℃1000rpm培养70min使抗性基因表达。 L-阿拉伯糖诱导Red/ET表达:取100μL转入pRed/ET并诱导抗性基因表达的大肠杆 菌于含四环素(3μg/mL)、氯霉素(15μg/mL)的LB平板,涂布均匀,30℃避光培养16h。挑取1个 单克隆于有1mL LB培养基(含3μg/mL四环素,15μg/mL氯霉素)的2mL盖子戳洞的离心管,30 ℃200rpm培养过夜。取30μL大肠杆菌于1个有1mL LB培养基(含3μg/mL四环素,15μg/mL氯霉 素)的2mL盖子戳洞的离心管,30℃1100rpm培养2h,直到OD600大约0.3。加入50μL L-阿拉伯 糖至终浓度为0.3-0.4%,37℃200rpm培养45-60min,诱导Red/ET表达。 电穿孔法将线性化的打靶载体PL451-loxP IRES-DTR CD45 3HA 5HA转化入表达 Red/ET的BAC Clone RP23-180D23:表达Red/ET的大肠杆菌进行离心,2℃11000rpm 30s,吸 弃上清。大肠杆菌沉淀用1mL冰上预冷的ddH20清洗3遍,最后留下约30μL ddH2O重悬大肠杆 菌,加入1-2μl(100-200ng)用NotI(NEB)酶切线性化的打靶载体PL451-loxP IRES-DTR CD45 3HA 5HA,轻弹混匀,冰上静置。转移大肠杆菌悬液至冰上预冷的1mm电穿孔管,利用 Electroporator 2510进行电穿孔,1350V 10μF 600 Ohms,将线性化的打靶载 体PL451-loxP IRES-DTR CD45 3HA 5HA转化入BAC Clone RP23-180D23。用1mL无抗生素LB 培养基重悬大肠杆菌并转移至2mL离心管,30℃1000rpm培养70min使IRES-DTR-PGK-EM7- Neo同源重组插入CD45 BAC,并表达新霉素抗性基因。取100μL大肠杆菌于含四环素(3μg/ mL)、氯霉素(15μg/mL)、新霉素(15μg/mL)的LB平板,涂布均匀,30℃培养大于20h,得到插入 IRES-DTR-PGK-EM7-Neo的大肠杆菌克隆,命名为BAC clone CD45-DTR。 外源基因靶向整合至小鼠CD45外显子1位点的BAC克隆的筛选与鉴定,整合的示意 图如附图4所示。 菌落PCR筛选靶向插入IRES-DTR-PGK-EM7-Neo的大肠杆菌BAC Clone:挑选XX个单 克隆分别于有10μl ddH2O的1.5mL离心管,吹打混匀。取1μl菌液作为模板,利用正向引物 G H p A - F - T T C T G A G G C G G A A A G A A C C ( S E Q I D N O .1 5 ) 和反向引物C D 4 5 - R - TATTTTGAACAGAAGCAGTGTATGC(SEQ ID NO.16)作菌落PCR。剩余菌液加入含5mL LB培养基 (含15μg/mL氯霉素,15μg/mL新霉素)的15mL离心管,37℃220rpm培养16h,pRed/ET在37℃时 会丢失。 菌落PCR反应体系如下: 9 CN 111607614 A 说 明 书 7/9 页 菌落PCR反应条件如下: PCR产物经1%琼脂糖凝胶电泳鉴定,靶向插入IRES-DTR-PGK-EM7-Neo至DC-SIGN 外显子7位点的大肠杆菌BAC阳性克隆可见约1kb条带,如附图5所示, PCR鉴定正确的靶向插入外源基因的阳性BAC克隆剩余菌液离心后去上清,用20% 甘油的LB培养基重悬,-80℃保存。 实施例2 插入CD45-DTR至小鼠胚胎干(ES)细胞: 小鼠胚胎成纤维细胞(MEFs)培养:MEFs(ATCC)培养和维持于MEF培养基,适时传代 和冻存。MEF培养基为DMEM培养基加入10%FBS、100U/ml青链霉素、0.05 mM 2巯基乙醇、2mM L-谷氨酰胺。 Balb/c ES细胞培养:MEFs细胞使用前用30Grayγ射线灭活处理作为滋养层细胞, 将Balb/c ES细胞(Merck)接种至灭活的MEFs上,用ES培养基培养和维持。ES细胞长至70% 丰度以1:3比例传代。ES培养基为DMEM培养基加入15%FBS、100U/ml青链霉素、1mM丙酮酸 钠、0.1mM非必需氨基酸、0.05mM 2巯基乙醇、2mM L-谷氨酰胺、1μg/L白血病抑制因子 (LIF)。 ES细胞电转:ES细胞经胰酶消化收集后,经PBS清洗1次,用电转缓冲液重悬 (Millipore),调整细胞密度至0.5X107/ml。将实施例1中制备的BAC clone CD45-DTR载体 经PI-SceI酶切线性化,将50μg线性化的打靶载体加入0.6mL上述ES细胞悬液,,并转移至 Eppendorf电转仪配套电转杯中,室温静置5min。利用 Electroporator 2510电 转仪320V 500μF电转,取出电转杯室温放置5min。转移至含30ml培养液的50ml离心管中混 匀,再均匀分配至事先准备好含滋养层细胞的3个10cm培养皿中,37℃5%CO2培养箱中培 养,CD45-DTR插入目标基因的原理如附图4所示。 插入BAC clone CD45-DTR的ES细胞的筛选和鉴定:电转后的ES细胞在24小时后, 换成含800μg/ml培养液,此后每天更换含药物的培养液。连续药物处理7天后,在尼康 SMZ1500显微镜下用特制吸管挑取胚胎干细胞单克隆并转移至事先准备好的含滋养层细胞 及培养液的48孔培养板中,每种打靶载体各挑取12个左右单克隆,于37℃5%CO2培养箱中 10 CN 111607614 A 说 明 书 8/9 页 培养。24小时后,用胰酶消化挑取的单克隆细胞并转移至新的事先准备好的含滋养层细胞 及培养液的48孔培养板中,于37℃5%CO2培养箱中培养3-4天,每天换液。待单克隆细胞长 至80%丰度,细胞经胰酶消化后,将细胞悬液均分转移至事先准备好的含滋养层细胞及培 养液的24孔培养板中,并于37℃5%CO2培养箱中培养。待细胞丰度达70%,消化和收集ES细 胞,利用QIAamp DNA Mini Kit(Qiagen)提取基因组DNA。以提取的小鼠ES细胞基因组DNA为 模板,利用正向引物ES-screen-F-ATTGCATCGCATTGTCTGAG(SEQ ID NO.17)和反向引物 ES-screen-R-CGAGTGGGGACTTACAGTGG(SEQ ID NO.18)进行PCR扩增。 PCR反应体系如下: PCR扩增条件为: PCR产物经1%琼脂糖凝胶电泳鉴定,插入BAC clone CD45-DTR的ES细胞阳性克隆 可见约1.4kb条带,如附图6所示。阳性克隆ES细胞消化后用胚胎干细胞冻存液(Millipore) 重悬,-80℃冻存备用。 实施例3 繁育插入BAC clone CD45-DTR转基因小鼠,流程如附图7所示。 囊胚注射ES细胞获得CD45-DTR转基因嵌合体小鼠:选8周龄发育良好的C57BL/6J 公鼠,与C57BL/6J母鼠按1:2合笼,次日清晨挑选阴栓阳性母鼠,若母鼠怀孕5天后可在子宫 取得囊胚。将结扎KM公鼠与正常KM母鼠按1:2合笼,选取有阴栓且阴门肿胀、红润的母鼠,即 为假孕KM母鼠。将插入CD45-DTR的ES细胞注射到C57BL/6J小鼠囊胚中,再接种到假孕的KM 母鼠子宫中,出生得到嵌合体小鼠(F0),即C57来源的细胞和BALB/c来源的ES细胞共同存在 于同一个体中,表现为动物毛色为黑色和白色混杂。 提取小鼠鼠尾DNA方法:小鼠鼠尾置于1.5mL离心管,加入300μL NaOH溶液(50mM), 金属浴100℃30min。冷却至室温,加入30μL Tris-HCl(1M,pH6.8)混匀调节pH。10000g离心 1min,上清即为含小鼠鼠尾DNA的溶液,可直接用于PCR。 鼠尾PCR鉴定转基因嵌合体小鼠:以转基因小鼠鼠尾DNA作为模板,利用正向引物 CD45 DTR-screen-F-GGTGGTGCTGAAGCTCTTTC (SEQ ID NO.19)和反向引物CD45-DTR-screen-R-CCCATGACACCTCTCTCCAT 11 CN 111607614 A 说 明 书 9/9 页 (SEQ ID NO.20)作PCR扩增,PCR反应体系同实施例2,PCR扩增条件同实施例2。PCR 产物经1%琼脂糖凝胶电泳鉴定,插入IRES-DTR的阳性小鼠可见约0.4kb条带,如附图8所 示。 繁育CD45-DTR转基因小鼠:白色占比越高的嵌合体小鼠,ES细胞发育成生殖细胞 的可能性越大,利用白色占比最高的5只雄性转基因嵌合体小鼠与BALB/c雌鼠交配,得到的 CD45-DTR转基因杂合小鼠应为白色。小白鼠经鼠尾PCR鉴定后得到CD45-DTR转基因杂合小 鼠,即为F1代小鼠。鼠尾PCR鉴定方法同上。F1代小鼠与C57BL/6J母鼠杂交进行传代,培育。 培养方法按照常规小鼠饲养模式进行。 实施例4 CD45-DTR转基因小鼠经白喉毒素诱导建立清除免疫细胞的小鼠模型。 本实施例采用腹腔注射白喉毒素(DT),检测小鼠淋脾脏中免疫细胞的占比来检测 免疫的敲除效率。 CD45-DTR转基因小鼠免疫细胞清除:CD45-DTR转基因小鼠在第1、第2、第4、第7天 分别腹腔注射DT(20ng/g),小鼠生长状态无明显变化。对照组小鼠在第1、第4天用4.5Gray γ射线照射4小时。第8天用脱颈椎法处死小鼠,取小鼠表皮,用流式细胞术检测淋巴结中免 疫细胞情况。 流式细胞术检测脾脏中免疫细胞表达:获取小鼠表皮,制备成单细胞悬液,用2% FCS-PBS重悬细胞,经Fc blocker封闭Fc受体后,利用anti-mouse-CD45流式抗体染色,染色 完毕洗去多余抗体,单细胞悬液用CytoFLEX LX Flow Cytometer上机检测。其中CD45代表 不同类型免疫细胞。经DT诱导后小鼠免疫细胞敲除如附图9所示,率约达80-90%,证明本发 明所述的方案能够很好的清除免疫细胞。 以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人 员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的 保护范围。 12 CN 111607614 A 序 列 表 1/8 页 SEQUENCE LISTING <110> 乾元康安(苏州)生物科技有限公司 <120> 白喉毒素调控清除免疫细胞的CD45-DTR转基因小鼠的构建方法与应用 <130> 2020 <160> 20 <170> PatentIn version 3.3 <210> 1 <211> 40 <212> DNA <213> 人工 <223> 引物CD45-5HA-F(KpnI) <400> 1 accaccggta ccgtgcaaag tatgcgttct tttcttttag 40 <210> 2 <211> 33 <212> DNA <213> 人工 <223> 引物CD45 -5HA-R(SalI) <400> 2 aacaacgtcg acatctggag atcagctgtg ccc 33 <210> 3 <211> 151 <212> DNA <213> 人工 <223> 基因片段DCSIGN 5HA <400> 3 accaccggta ccgtgcaaag tatgcgttct tttcttttag ttttgactta gctttacaga 60 gacaaacttc aagagagata accattattt tgcctttcag ggagacccta tttcttaggg 120 gcacagctga tctccagatg tcgacgttgt t 151 <210> 4 <211> 30 <212> DNA <213> 人工 <223> 引物IRES-F(SalI) <400> 4 accaccgtcg acgcccctct ccctcccccc 30 <210> 5 <211> 27 13 CN 111607614 A 序 列 表 2/8 页 <212> DNA <213> 人工 <223> 引物IRES-R <400> 5 catggttgtg gcaagcttat catcgtg 27 <210> 6 <211> 602 <212> DNA <213> 人工 <223> 基因片段IRES <400> 6 accaccgtcg agcccctctc cctccccccc ccctaacgtt actggccgaa gccgcttgga 60 ataaggccgg tgtgcgtttg tctatatgtt attttccacc atattgccgt cttttggcaa 120 tgtgagggcc cggaaacctg gccctgtctt cttgacgagc attcctaggg gtctttcccc 180 tctcgccaaa ggaatgcaag gtctgttgaa tgtcgtgaag gaagcagttc ctctggaagc 240 ttcttgaaga caaacaacgt ctgtagcgac cctttgcagg cagcggaacc ccccacctgg 300 cgacaggtgc ctctgcggcc aaaagccacg tgtataagat acacctgcaa aggcggcaca 360 accccagtgc cacgttgtga gttggatagt tgtggaaaga gtcaaatggc tctcctcaag 420 cgtattcaac aaggggctga aggatgccca gaaggtaccc cattgtatgg gatctgatct 480 ggggcctcgg tgcacatgct ttacatgtgt ttagtcgagg ttaaaaaacg tctaggcccc 540 ccgaaccacg gggacgtggt tttcctttga aaaacacgat gataagcttg ccacaaccat 600 ga 602 <210> 7 <211> 42 <212> DNA <213> 人工 <223> 引物DTR-F <400> 7 cacgatgata agcttgccac aaccatgaag ctgctgccgt cg 42 <210> 8 <211> 34 <212> DNA <213> 人工 <223> 引物DTR-R(EcoRI) <400> 8 accaccgaat tcttagtggg aattagtcat gccc 34 <210> 9 <211> 663 <212> DNA 14 CN 111607614 A 序 列 表 3/8 页 <213> 人工 <223> 基因片段DTR <400> 9 cacgatgata agcttgccac aaccatgaag ctgctgccgt cggtggtgct gaagctcttt 60 ctggctgcag ttctctcggc actggtgact ggcgagagcc tggagcggct tcggagaggg 120 ctagctgctg gaaccagcaa cccggaccct cccactgtat ccacggacca gctgctaccc 180 ctaggaggcg gccgggaccg gaaagtccgt gacttgcaag aggcagatct ggaccttttg 240 agagtcactt tatcctccaa gccacaagca ctggccacac caaacaagga ggagcacggg 300 aaaagaaaga agaaaggcaa ggggctaggg aagaagaggg acccatgtct tcggaaatac 360 aaggacttct gcatccatgg agaatgcaaa tatgtgaagg agctccgggc tccctcctgc 420 atctgccacc cgggttacca tggagagagg tgtcatgggc tgagcctccc agtggaaaat 480 cgcttatata cctatgacca cacaaccatc ctggccgtgg tggctgtggt gctgtcatct 540 gtctgtctgc tggtcatcgt ggggcttctc atgtttaggt accataggag aggaggttat 600 gatgtggaaa atgaagagaa agtgaagttg ggcatgacta attcccacta agaattcggt 660 ggt 663 <210> 10 <211> 1238 <212> DNA <213> 人工 <223> 基因片段IRES-DTR <400> 10 accaccgtcg acgcccctct ccctcccccc cccctaacgt tactggccga agccgcttgg 60 aataaggccg gtgtgcgttt gtctatatgt tattttccac catattgccg tcttttggca 120 atgtgagggc ccggaaacct ggccctgtct tcttgacgag cattcctagg ggtctttccc 180 ctctcgccaa aggaatgcaa ggtctgttga atgtcgtgaa ggaagcagtt cctctggaag 240 cttcttgaag acaaacaacg tctgtagcga ccctttgcag gcagcggaac cccccacctg 300 gcgacaggtg cctctgcggc caaaagccac gtgtataaga tacacctgca aaggcggcac 360 aaccccagtg ccacgttgtg agttggatag ttgtggaaag agtcaaatgg ctctcctcaa 420 gcgtattcaa caaggggctg aaggatgccc agaaggtacc ccattgtatg ggatctgatc 480 tggggcctcg gtgcacatgc tttacatgtg tttagtcgag gttaaaaaac gtctaggccc 540 cccgaaccac ggggacgtgg ttttcctttg aaaaacacga tgataagctt gccacaacca 600 tgaagctgct gccgtcggtg gtgctgaagc tctttctggc tgcagttctc tcggcactgg 660 tgactggcga gagcctggag cggcttcgga gagggctagc tgctggaacc agcaacccgg 720 accctcccac tgtatccacg gaccagctgc tacccctagg aggcggccgg gaccggaaag 780 tccgtgactt gcaagaggca gatctggacc ttttgagagt cactttatcc tccaagccac 840 aagcactggc cacaccaaac aaggaggagc acgggaaaag aaagaagaaa ggcaaggggc 900 tagggaagaa gagggaccca tgtcttcgga aatacaagga cttctgcatc catggagaat 960 gcaaatatgt gaaggagctc cgggctccct cctgcatctg ccacccgggt taccatggag 1020 agaggtgtca tgggctgagc ctcccagtgg aaaatcgctt atatacctat gaccacacaa 1080 15 CN 111607614 A 序 列 表 4/8 页 ccatcctggc cgtggtggct gtggtgctgt catctgtctg tctgctggtc atcgtggggc 1140 ttctcatgtt taggtaccat aggagaggag gttatgatgt ggaaaatgaa gagaaagtga 1200 agttgggcat gactaattcc cactaagaat tcggtggt 1238 <210> 11 <211> 34 <212> DNA <213> 人工 <223> 引物CD45-3HA-F(BamHI) <400> 11 accaccggat ccaccatggg tttgtggctc aaac 34 <210> 12 <211> 42 <212> DNA <213> 人工 <223> 引物CD45-3HA-R(NotI) <400> 12 accaccgcgg ccgcatccat cacacgcaac ttttaaaaat ag 42 <210> 13 <211> 196 <212> DNA <213> 人工 <223> 基因片段CD45 3HA <400> 13 accaccggat ccaccatggg tttgtggctc aaacttctgg cctttggatt tgcccttctg 60 gacacagaag tctttgtcac aggtaagcac acccatattc atttttactt ccttgtattt 120 tgttgatttt gtggcaaagg ctaggttgaa atggctattt ttaaaagttg cgtgtgatgg 180 atgcggccgc gttgtt 196 <210> 14 <211> 6307 <212> DNA <213> 人工 <223> 打靶载体PL451-loxP IRES-DTR CD45 3HA 5HA <400> 14 ctaaattgta agcgttaata ttttgttaaa attcgcgtta aatttttgtt aaatcagctc 60 attttttaac caataggccg aaatcggcaa aatcccttat aaatcaaaag aatagaccga 120 gatagggttg agtgttgttc cagtttggaa caagagtcca ctattaaaga acgtggactc 180 caacgtcaaa gggcgaaaaa ccgtctatca gggcgatggc ccactacgtg aaccatcacc 240 ctaatcaagt tttttggggt cgaggtgccg taaagcacta aatcggaacc ctaaagggag 300 cccccgattt agagcttgac ggggaaagcc ggcgaacgtg gcgagaaagg aagggaagaa 360 16 CN 111607614 A 序 列 表 5/8 页 agcgaaagga gcgggcgcta gggcgctggc aagtgtagcg gtcacgctgc gcgtaaccac 420 cacacccgcc gcgcttaatg cgccgctaca gggcgcgtcc cattcgccat tcaggctgcg 480 caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc tggcgaaagg 540 gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt cacgacgttg 600 taaaacgacg gccagtgaat tgtaatacga ctcactatag ggcgaattgg gatccgtgca 660 aagtatgcgt tcttttcttt tagttttgac ttagctttac agagacaaac ttcaagagag 720 ataaccatta ttttgccttt cagggagacc ctatttctta ggggcacagc tgatctccag 780 atgtcgacgc ccctctccct cccccccccc taacgttact ggccgaagcc gcttggaata 840 aggccggtgt gcgtttgtct atatgttatt ttccaccata ttgccgtctt ttggcaatgt 900 gagggcccgg aaacctggcc ctgtcttctt gacgagcatt cctaggggtc tttcccctct 960 cgccaaagga atgcaaggtc tgttgaatgt cgtgaaggaa gcagttcctc tggaagcttc 1020 ttgaagacaa acaacgtctg tagcgaccct ttgcaggcag cggaaccccc cacctggcga 1080 caggtgcctc tgcggccaaa agccacgtgt ataagataca cctgcaaagg cggcacaacc 1140 ccagtgccac gttgtgagtt ggatagttgt ggaaagagtc aaatggctct cctcaagcgt 1200 attcaacaag gggctgaagg atgcccagaa ggtaccccat tgtatgggat ctgatctggg 1260 gcctcggtgc acatgcttta catgtgttta gtcgaggtta aaaaacgtct aggccccccg 1320 aaccacgggg acgtggtttt cctttgaaaa acacgatgat aatatggcca caaccatgaa 1380 gctgctgccg tcggtggtgc tgaagctctt tctggctgca gttctctcgg cactggtgac 1440 tggcgagagc ctggagcggc ttcggagagg gctagctgct ggaaccagca acccggaccc 1500 tcccactgta tccacggacc agctgctacc cctaggaggc ggccgggacc ggaaagtccg 1560 tgacttgcaa gaggcagatc tggacctttt gagagtcact ttatcctcca agccacaagc 1620 actggccaca ccaaacaagg aggagcacgg gaaaagaaag aagaaaggca aggggctagg 1680 gaagaagagg gacccatgtc ttcggaaata caaggacttc tgcatccatg gagaatgcaa 1740 atatgtgaag gagctccggg ctccctcctg catctgccac ccgggttacc atggagagag 1800 gtgtcatggg ctgagcctcc cagtggaaaa tcgcttatat acctatgacc acacaaccat 1860 cctggccgtg gtggctgtgg tgctgtcatc tgtctgtctg ctggtcatcg tggggcttct 1920 catgtttagg taccatagga gaggaggtta tgatgtggaa aatgaagaga aagtgaagtt 1980 gggcatgact aattcccact aaacgcgtac cgggcccccc ctcgaggtcg acggtatcga 2040 taagcttgat atcgaattcc gaagttccta ttctctagaa agtataggaa cttcaggtct 2100 gaagaggagt ttacgtccag ccaagctagc ttggctgcag gtcgtcgaaa ttctaccggg 2160 taggggaggc gcttttccca aggcagtctg gagcatgcgc tttagcagcc ccgctgggca 2220 cttggcgcta cacaagtggc ctctggcctc gcacacattc cacatccacc ggtaggcgcc 2280 aaccggctcc gttctttggt ggccccttcg cgccaccttc tactcctccc ctagtcagga 2340 agttcccccc cgccccgcag ctcgcgtcgt gcaggacgtg acaaatggaa gtagcacgtc 2400 tcactagtct cgtgcagatg gacagcaccg ctgagcaatg gaagcgggta ggcctttggg 2460 gcagcggcca atagcagctt tgctccttcg ctttctgggc tcagaggctg ggaaggggtg 2520 ggtccggggg cgggctcagg ggcgggctca ggggcggggc gggcgcccga aggtcctccg 2580 gaggcccggc attctgcacg cttcaaaagc gcacgtctgc cgcgctgttc tcctcttcct 2640 catctccggg cctttcgacc tgcagcctgt tgacaattaa tcatcggcat agtatatcgg 2700 17 CN 111607614 A 序 列 表 6/8 页 catagtataa tacgacaagg tgaggaacta aaccatggga tcggccattg aacaagatgg 2760 attgcacgca ggttctccgg ccgcttgggt ggagaggcta ttcggctatg actgggcaca 2820 acagacaatc ggctgctctg atgccgccgt gttccggctg tcagcgcagg ggcgcccggt 2880 tctttttgtc aagaccgacc tgtccggtgc cctgaatgaa ctgcaggacg aggcagcgcg 2940 gctatcgtgg ctggccacga cgggcgttcc ttgcgcagct gtgctcgacg ttgtcactga 3000 agcgggaagg gactggctgc tattgggcga agtgccgggg caggatctcc tgtcatctca 3060 ccttgctcct gccgagaaag tatccatcat ggctgatgca atgcggcggc tgcatacgct 3120 tgatccggct acctgcccat tcgaccacca agcgaaacat cgcatcgagc gagcacgtac 3180 tcggatggaa gccggtcttg tcgatcagga tgatctggac gaagagcatc aggggctcgc 3240 gccagccgaa ctgttcgcca ggctcaaggc gcgcatgccc gacggcgagg atctcgtcgt 3300 gacccatggc gatgcctgct tgccgaatat catggtggaa aatggccgct tttctggatt 3360 catcgactgt ggccggctgg gtgtggcgga ccgctatcag gacatagcgt tggctacccg 3420 tgatattgct gaagagcttg gcggcgaatg ggctgaccgc ttcctcgtgc tttacggtat 3480 cgccgctccc gattcgcagc gcatcgcctt ctatcgcctt cttgacgagt tcttctgagg 3540 ggatcaattc tctagagctc gctgatcagc ctcgactgtg ccttctagtt gccagccatc 3600 tgttgtttgc ccctcccccg tgccttcctt gaccctggaa ggtgccactc ccactgtcct 3660 ttcctaataa aatgaggaaa ttgcatcgca ttgtctgagt aggtgtcatt ctattctggg 3720 gggtggggtg gggcaggaca gcaaggggga ggattgggaa gacaatagca ggcatgctgg 3780 ggatgcggtg ggctctatgg cttctgaggc ggaaagaacc agctggggct cgactagagc 3840 ttgcggaacc cttcgaagtt cctattctct agaaagtata ggaacttcat cagtcaggta 3900 cataatggat ctaccatggg tttgtggctc aaacttctgg cctttggatt tgcccttctg 3960 gacacagaag tctttgtcac aggtaagcac acccatattc atttttactt ccttgtattt 4020 tgttgatttt gtggcaaagg ctaggttgaa atggctattt ttaaaagttg cgtgtgatgg 4080 atgcggccgc caccgcggtg gagctccagc ttttgttccc tttagtgagg gttaatttcg 4140 agcttggcgt aatcatggtc atagctgttt cctgtgtgaa attgttatcc gctcacaatt 4200 ccacacaaca tacgagccgg aagcataaag tgtaaagcct ggggtgccta atgagtgagc 4260 taactcacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa cctgtcgtgc 4320 cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat tgggcgctct 4380 tccgcttcct cgctcactga ctcgctgcgc tcggtcgttc ggctgcggcg agcggtatca 4440 gctcactcaa aggcggtaat acggttatcc acagaatcag gggataacgc aggaaagaac 4500 atgtgagcaa aaggccagca aaaggccagg aaccgtaaaa aggccgcgtt gctggcgttt 4560 ttccataggc tccgcccccc tgacgagcat cacaaaaatc gacgctcaag tcagaggtgg 4620 cgaaacccga caggactata aagataccag gcgtttcccc ctggaagctc cctcgtgcgc 4680 tctcctgttc cgaccctgcc gcttaccgga tacctgtccg cctttctccc ttcgggaagc 4740 gtggcgcttt ctcatagctc acgctgtagg tatctcagtt cggtgtaggt cgttcgctcc 4800 aagctgggct gtgtgcacga accccccgtt cagcccgacc gctgcgcctt atccggtaac 4860 tatcgtcttg agtccaaccc ggtaagacac gacttatcgc cactggcagc agccactggt 4920 aacaggatta gcagagcgag gtatgtaggc ggtgctacag agttcttgaa gtggtggcct 4980 aactacggct acactagaag aacagtattt ggtatctgcg ctctgctgaa gccagttacc 5040 18 CN 111607614 A 序 列 表 7/8 页 ttcggaaaaa gagttggtag ctcttgatcc ggcaaacaaa ccaccgctgg tagcggtggt 5100 ttttttgttt gcaagcagca gattacgcgc agaaaaaaag gatctcaaga agatcctttg 5160 atcttttcta cggggtctga cgctcagtgg aacgaaaact cacgttaagg gattttggtc 5220 atgagattat caaaaaggat cttcacctag atccttttaa attaaaaatg aagttttaaa 5280 tcaatctaaa gtatatatga gtaaacttgg tctgacagtt accaatgctt aatcagtgag 5340 gcacctatct cagcgatctg tctatttcgt tcatccatag ttgcctgact ccccgtcgtg 5400 tagataacta cgatacggga gggcttacca tctggcccca gtgctgcaat gataccgcga 5460 gacccacgct caccggctcc agatttatca gcaataaacc agccagccgg aagggccgag 5520 cgcagaagtg gtcctgcaac tttatccgcc tccatccagt ctattaattg ttgccgggaa 5580 gctagagtaa gtagttcgcc agttaatagt ttgcgcaacg ttgttgccat tgctacaggc 5640 atcgtggtgt cacgctcgtc gtttggtatg gcttcattca gctccggttc ccaacgatca 5700 aggcgagtta catgatcccc catgttgtgc aaaaaagcgg ttagctcctt cggtcctccg 5760 atcgttgtca gaagtaagtt ggccgcagtg ttatcactca tggttatggc agcactgcat 5820 aattctctta ctgtcatgcc atccgtaaga tgcttttctg tgactggtga gtactcaacc 5880 aagtcattct gagaatagtg tatgcggcga ccgagttgct cttgcccggc gtcaatacgg 5940 gataataccg cgccacatag cagaacttta aaagtgctca tcattggaaa acgttcttcg 6000 gggcgaaaac tctcaaggat cttaccgctg ttgagatcca gttcgatgta acccactcgt 6060 gcacccaact gatcttcagc atcttttact ttcaccagcg tttctgggtg agcaaaaaca 6120 ggaaggcaaa atgccgcaaa aaagggaata agggcgacac ggaaatgttg aatactcata 6180 ctcttccttt ttcaatatta ttgaagcatt tatcagggtt attgtctcat gagcggatac 6240 atatttgaat gtatttagaa aaataaacaa ataggggttc cgcgcacatt tccccgaaaa 6300 gtgccac 6307 <210> 15 <211> 25 <212> DNA <213> 人工 <223> 引物GHpA-F <400> 15 tattttgaac agaagcagtg tatgc 25 <210> 16 <211> 25 <212> DNA <213> 人工 <223> 引物DCSIGN-R <400> 16 tattttgaac agaagcagtg tatgc 25 <210> 17 <211> 20 <212> DNA 19 CN 111607614 A 序 列 表 8/8 页 <213> 人工 <223> 引物ES-screen-F <400> 17 attgcatcgc attgtctgag 20 <210> 18 <211> 20 <212> DNA <213> 人工 <223> 引物ES-screen-R <400> 18 cgagtgggga cttacagtgg 20 <210> 19 <211> 20 <212> DNA <213> 人工 <223> 引物CD45 DTR-screen-F <400> 19 ggtggtgctg aagctctttc 20 <210> 20 <211> 20 <212> DNA <213> 人工 <223> 引物CD45-DTR-screen-R <400> 20 cccatgacac ctctctccat 20 20 CN 111607614 A 说 明 书 附 图 1/5 页 图1 21 CN 111607614 A 说 明 书 附 图 2/5 页 图2 22 CN 111607614 A 说 明 书 附 图 3/5 页 图3 图4 23 CN 111607614 A 说 明 书 附 图 4/5 页 图5 图6 图7 24 CN 111607614 A 说 明 书 附 图 5/5 页 图8 图9 25












