技术摘要:
本发明公开了一种用于治疗耐药肿瘤的靶向细胞外囊泡的制备方法,包括:1、制备负载DOX的EVs;2、制备具有靶向CD44的透明质酸衍生物;3、将具有靶向CD44的透明质酸衍生物修饰于负载DOX的EVs表面。细胞外囊泡来源于非肿瘤细胞,它可通过抑制组蛋白乙酰化转移酶的蛋白表达 全部
背景技术:
肿瘤目前是严重威胁人类健康的常见病,化疗是治疗肿瘤的重要临床手段,然而 肿瘤细胞的化疗耐药常常导致化疗失败。耐药形成机制复杂,其中多药耐药基因(ABCB1)编 码的P糖蛋白(P-gp)过度表达是细胞产生耐药的主要原因,能量依赖性P-gp能将药物泵出 细胞外,减少细胞内药物蓄积,导致肿瘤细胞耐药。 细胞外囊泡是由细胞释放至细胞外环境的直径在50-1000nm之间的膜性囊泡,内 含来自母细胞的特异性生物活性分子,如脂质、核酸和蛋白质。鉴于EVs是细胞间信息交流 的载体,可被受体细胞有效摄取,它已被作为一类天然的新型药物递送系统运用于不同疾 病的治疗。其主要优势在于:1)鉴于它来源于生物体或细胞本身,因此具有良好的生物相容 性、极低的免疫原性、可在血液循环中稳定存在;2)可装载多种化疗药物、基因药物及多肽; 3)可通过遗传学或化学工程的方式对其进行修饰改造;4)可自由穿越生物体内一些特殊的 生理屏障,如血-脑屏障。 目前有研究表明肿瘤源性的EVs具有通过下调P-gp来逆转耐药的潜能,但也有越 来越多的研究证实:1)肿瘤源性的EVs可通过横向传递自身携带的促癌基因或蛋白质给受 体细胞,从而促进肿瘤的发生;2)可通过促进细胞发生上皮细胞—间充质转换及制造转移 前微环境来促进肿瘤转移;3)可通过对机体免疫细胞的调节来介导肿瘤细胞的免疫耐受。 因此,需要寻找一种安全、有效、非肿瘤源性的EVs运用于逆转肿瘤耐药的研究。 肿瘤的靶向治疗可使化疗药物特异性杀伤癌细胞的同时,减少其对正常组织的毒 副作用。细胞粘附分子CD44是一种多功能细胞表面跨膜糖蛋白,许多肿瘤细胞表面CD44处 于高度活化状态,能与其主要配体透明质酸结合,因此CD44可作为理想的靶点分子,用于肿 瘤靶向性的诊断与治疗。由于大部分细胞源性的EVs靶向性较差,可通过将具有靶向CD44的 透明质酸衍生物修饰在其表面,使其具有靶向性,以增加对耐药肿瘤的治疗效果,但目前鲜 有这方面的成熟技术研究。 申请号201811010632.0的发明专利提出了一种构建靶向细胞外囊泡的方法,利用 脂质化的适配体或脂质化的抗体等靶向分子来标记磷脂双分子层包裹的细胞(包括哺乳动 物来源的细胞、人工合成细胞等等),待整个细胞膜都携带有适体抗体后,通过机械力来破 碎细胞,再分离出直径10-3000nm的EVs。这些EVs因为膜上带有适体或抗体,从而具有靶向 性,因此可作为疾病治疗的靶向载体。但是这种先修饰细胞膜,然后使用机械力破碎细胞制 备EVs的方式可能会破坏已修饰的靶向分子或造成靶向分子脱落,从而降低EVs的靶向性。 其次,没有限定为非肿瘤细胞源性的EVs为药物载体,安全性差,按照上述对肿瘤源性的EVs 的分析,仍然不能很好抑制肿瘤。 4 CN 111544391 A 说 明 书 2/8 页
技术实现要素:
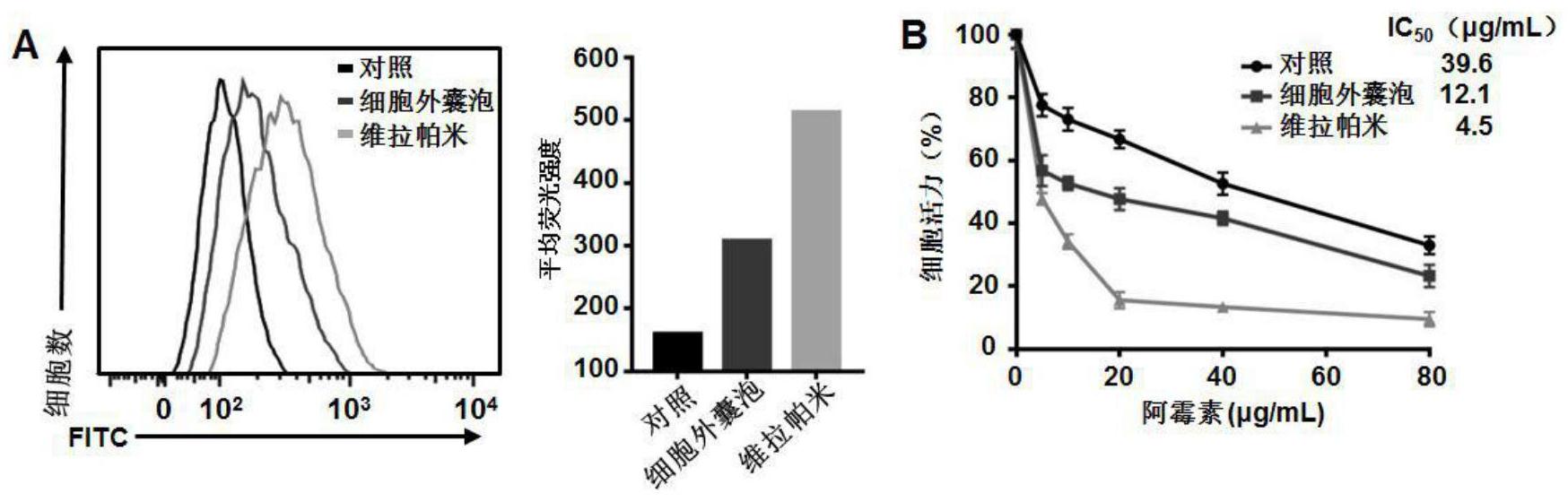
(一)解决的技术问题 本发明的目的在于提供一种用于治疗耐药肿瘤的靶向细胞外囊泡的制备方法,以 解决现有技术没有一种安全有效的非肿瘤源性的EVs运用于逆转肿瘤耐药的问题,且先修 饰细胞膜,然后使用机械力破碎细胞制备EVs的方式可能会破坏已修饰的靶向分子或造成 靶向分子脱落。另外,没有利用具有靶向CD44的透明质酸衍生物修饰在细胞源性的EVs表面 的成熟技术研究。 (二)技术方案 为实现上述用于治疗耐药肿瘤的靶向细胞外囊泡的制备方法解决现有技术没有 一种安全有效的非肿瘤源性的EVs运用于逆转肿瘤耐药的问题,且先修饰细胞膜,然后使用 机械力破碎细胞制备EVs的方式可能会破坏已修饰的靶向分子或造成靶向分子脱落。另外, 没有利用具有靶向CD44的透明质酸衍生物修饰在细胞源性的EVs表面的成熟技术研究。本 发明提供如下技术方案: 一种用于治疗耐药肿瘤的靶向细胞外囊泡的制备方法,包括以下步骤: 步骤1、制备负载DOX的EVs,EVs来源于非肿瘤细胞系细胞的培养上清,联合紫外照 射及与药物DOX培养共刺激的方式获取; 步骤2、制备具有靶向CD44的透明质酸衍生物; 步骤3、将具有靶向CD44的透明质酸衍生物修饰于负载DOX的EVs表面。 优选的,所述步骤1具体为: 将细胞密度为90%左右的细胞置于紫外线下照射0.5~4小时; 向细胞上清中加入100~500μg/mL化疗药物DOX; 将细胞置于37℃细胞培养箱中培养16~24小时; 收集细胞上清,经4℃,600~4000g离心20分钟; 弃去细胞沉淀,保留细胞上清,经4℃,14000~17000g离心2分钟,进一步去掉细胞 碎片; 将上清经4℃,14000~17000g离心60~75分钟,保留底部载药的细胞外囊泡沉淀, 经PBS重悬后洗涤,放置4℃储存备用。 优选的,所述步骤2具体为: 将酸化后的透明质酸、1-(3-二甲胺基)丙基-3-乙基碳化二亚胺盐酸盐(EDC· HCl)和N-羟基丁二酰亚胺(NHS)溶解于无水二甲亚砜中,室温搅拌30~60min; 向混合物中加入亲脂性小分子化合物,于60℃搅拌24~48小时; 将反应液置于3.5kDa透析袋中,并于50%乙醇中透析24~48小时,之后将50%乙 醇溶液换成去离子水继续透析48~72小时; 将反应物置于真空冷冻干燥机中冷冻干燥。 优选的,所述步骤3具体为:将步骤1制备的载有DOX的hEVs与步骤2制备的透明质 酸衍生物混合后置于摇床上于常温下摇晃、孵育15~60分钟;经4℃,14000~17000g离心60 ~75分钟,获得负载阿霉素的透明质酸衍生物修饰的hEVs;经PBS重悬后洗涤,放置4℃储存 备用。 优选的,所述步骤1的紫外线强度为100~500J/m2。 5 CN 111544391 A 说 明 书 3/8 页 优选的,所述步骤2的透明质酸为50~200mg,1-(3-二甲胺基)丙基-3-乙基碳化二 亚胺盐酸盐(EDC·HCl)为13~60mg,N-羟基丁二酰亚胺(NHS)为8~24mg,无水二甲亚砜5~ 20mL,亲脂性小分子化合物为10~40mg。 优选的,所述步骤3的透明质酸衍生物为20~100μg/mL。 优选的,所述非肿瘤细胞系细胞包括但不限于HEK293T细胞、HUVEC细胞、RAW 264.7细胞、L-929细胞以及原代提取的BMSCs细胞。 优选的,所述亲脂性小分子化合物包括但不限于十八烷基胺、十六烷基胺、油胺、 胆固醇氯甲酸酯。 (三)有益效果 与现有技术相比,本发明提供了一种用于治疗耐药肿瘤的靶向细胞外囊泡的制备 方法,具备以下有益效果: (1)本发明通过将具有靶向CD44的透明质酸衍生物修饰在细胞源性的EVs表面,靶 向性更好,减少了化疗药物对正常器官的毒副作用。 (2)本发明包括制备负载DOX的EVs、制备具有靶向CD44的透明质酸衍生物、将具有 靶向CD44的透明质酸衍生物修饰于负载DOX的EVs表面三个步骤,操作过程简单快捷、便于 制备,且采用先处理细胞后修饰的方法避免了现有技术破坏已修饰的靶向分子的情况。 (3)本发明以具有下调P-gp水平功能的非肿瘤细胞源性的EVs为药物载体,减少肿 瘤细胞对化疗药物的外排作用,相比现有技术采用肿瘤细胞源性的EVs为药物载体抑制肿 瘤性能更好,安全性好。 附图说明 图1为不同细胞源性的EVs对耐药细胞中P-gp的功能影响说明图。 图2为HEK293T细胞源性的EVs(hEVs)对耐药细胞中P-gp功能的持续性影响说明 图。 图3为hEVs通过抑制组蛋白乙酰化转移酶PCAF和GCN5的蛋白表达来减少耐药基因 ABCB1启动子区组蛋白H3的乙酰化水平,干扰对应的耐药蛋白P-gp的蛋白及mRNA的表达说 明图。 图4为透明质酸衍生物核磁图。 图5为验证透明质酸衍生物(被FITC标记)可以插入HEK293T细胞膜内示意图。 图6为透明质酸衍生物(被FITC标记)可修饰hEVs说明图。 图7为透明质酸衍生物修饰的hEVs的透射电镜图和粒径分布情况图。 图8为透明质酸衍生物修饰对hEVs负载阿霉素含量的影响说明图。 图9为透明质酸衍生物修饰的hEVs的细胞相容性和溶血实验坐标图。 图10为MCF7/ADR细胞对透明质酸衍生物修饰的hEVs的摄取实验示意图。 图11为流式细胞术检测负载阿霉素的透明质酸衍生物修饰的hEVs诱导MCF7/ADR 细胞凋亡实验坐标图。 图12为透明质酸衍生物修饰的hEVs负载阿霉素的体内分布说明图。 图13为负载阿霉素的透明质酸衍生物修饰的hEVs对耐药乳腺癌荷瘤小鼠肿瘤抑 制实验说明图。 6 CN 111544391 A 说 明 书 4/8 页












