技术摘要:
本发明公开了一种鳕鱼皮寡肽及其分离纯化方法和应用,该鳕鱼皮寡肽的氨基酸序列为Phe‑Tyr‑Glu。分离纯化方法包括:以阿拉斯加狭鳕鱼皮为原料,蛋白酶酶解法制备鳕鱼皮胶原肽混合肽;再依次进行超滤处理、葡聚糖凝胶色谱柱粗分以及高效液相色谱分离;葡聚糖凝胶色谱柱 全部
背景技术:
阿拉斯加狭鳕鱼。学名为Theragra chalcogramma,生活在大西洋北部,是一种冷 水性深海鱼类,肉质细嫩,肉味清淡,由于其长期的生长环境特殊(低温、高压),其鱼蛋白 (鱼肉、鱼皮等)的氨基酸组成及氨基酸序列可能有别于其他的浅海鱼及淡水鱼等。 鳕鱼皮胶原肽是以鳕鱼皮为原料,利用酶法制得而成的一类蛋白质、多肽、寡肽和 氨基酸的混合物(含量以寡肽为主)。其中的寡肽是一类氨基酸残基数目在2~12个的小肽。 如申请公布号为CN 108530530 A的中国专利文献中公开了一种鳕鱼鱼皮胶原肽 的制备方法,包括:1)将鱼皮除杂清洗后粉碎成浆,经酸洗、碱洗后再水洗至中性;2)将步骤 1)处理后的鱼皮加入热水中保温;3)将步骤2)得到的蛋白提取液中加入蛋白酶,经两次酶 解处理;4)将酶解后的浆液用离心机除去固体残渣,所得清液经超滤膜去除少量大分子杂 质,再用纳滤膜去除无机盐和小分子杂质并浓缩,得到鱼皮胶原肽溶液,经喷雾干燥得到鱼 皮胶原肽粉末。 再如申请公布号为CN 104152518 A的中国专利文献中公开了一种肝病辅食型鳕 鱼皮胶原蛋白肽的制备方法,包括:(1)鳕鱼皮预处理;(2)酶解反应:加入胰蛋白酶酶解反 应;(3)超滤得GM2组分;(4)DEAE-SepharoseFF离子交换层析分离得到GM2-2组分,冷冻干燥 得到胶原蛋白酶。 但以上技术方案得到的胶原肽或胶原蛋白酶均属于大分子肽或蛋白质,其分离方 法不适用于鳕鱼皮寡肽的分离纯化。 分子量较小的鳕鱼皮寡肽之间分子量较为接近,而且其他物性如带电性、疏水性 等差别不明显,利用传统膜分离方式或采用单一填料的层析分离法无法分离生物活性较高 的组分。 目前已报道的鱼皮寡肽的生物活性有抗氧化、降血糖、提高免疫功能等,如WANG等 (WANG T Y ,HSIEH C H ,HUNG CC ,et al .Fish skin gelatin hydrolysates as dipeptidyl peptidase IV inhibitors and glucagon-like peptide-1stimulators improve glycaemic control in diabeticrats:a comparison between warm-and cold- water fish[J].)对比目鱼和罗非鱼的鱼皮进行水解,经分离纯化后得到一种二肽基肽酶, 发现其可以促进胰高血糖素样肽和胰岛素的分泌,进而发挥调节血糖的作用。 糖尿病是一组以高血糖为特征的代谢性疾病,高血糖则是由于胰岛素分泌缺陷或 3 CN 111574585 A 说 明 书 2/8 页 其生物作用受损,或两者兼有引起。降糖药按照降糖机理大致分为三种:(1)刺激胰岛素的 分泌或胰岛素制剂,如磺脲类药物;(2)增加外周组织对葡萄糖的利用,如双胍类降糖药; (3)ɑ-葡萄糖苷酶抑制剂,如临床上常用的阿卡波糖等。 目前公开的具有降血糖功效的鱼皮寡肽均是遵循机理(1)发挥调节血糖的作用, 还未有公开其它的降糖机理。
技术实现要素:
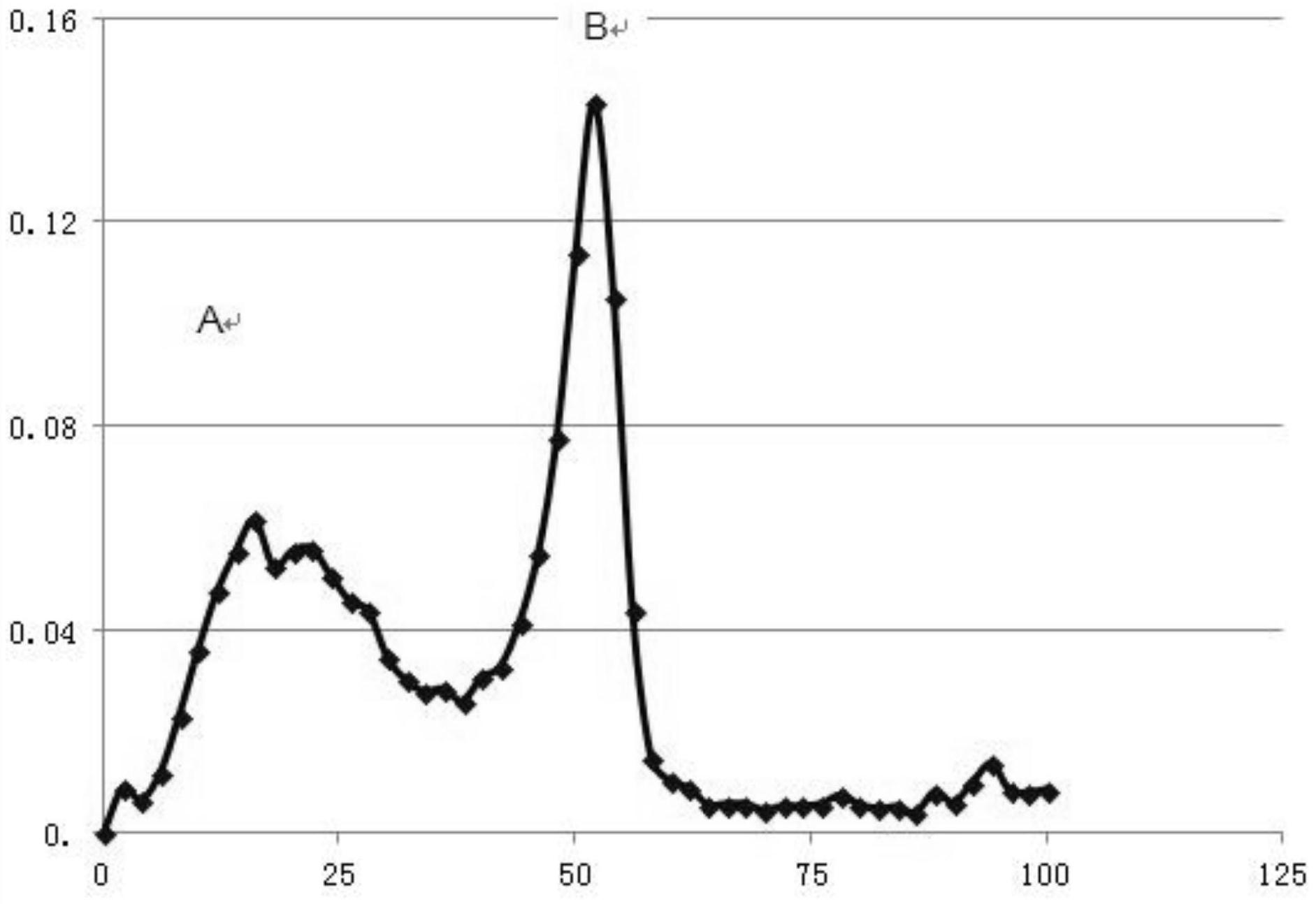
本发明针对现有技术中存在的问题,提供了具有新型氨基酸序列的三种鳕鱼皮寡 肽及其分离纯化工艺,经活性试验发现,该三种鳕鱼皮寡肽具有ɑ-葡萄糖苷酶抑制活性,能 辅助降血糖,可用于制备抗Ⅱ型糖尿病药物。 具体技术方案如下: 一种鳕鱼皮寡肽,氨基酸序列分别为Glu-Gly-Gly-Tyr-Thr-Arg、Tyr-Val-Arg或 Phe-Tyr-Glu。 本发明还公开了所述鳕鱼皮寡肽的分离纯化方法,包括: (1)以阿拉斯加狭鳕鱼皮为原料,经蛋白酶酶解法制备鳕鱼皮胶原肽混合肽; 所述蛋白酶酶解法具体为: 将阿拉斯加狭鳕鱼皮、胰酶与水混合,在52~58℃、pH=5.5~6.5下酶解6~10h; 以阿拉斯加狭鳕鱼皮的质量计,所述胰酶的加入量为0.15~0.25wt%; 所述阿拉斯加狭鳕鱼皮与水的质量比为1:4~8; (2)采用截留分子量为3000Da的超滤膜对步骤(1)制备的鳕鱼皮胶原肽混合肽进 行超滤处理,再经浓缩、干燥得到鳕鱼皮胶原肽; (3)以水为流动相,采用葡聚糖凝胶色谱柱对步骤(2)制备的鳕鱼皮胶原肽进行粗 分; 所述葡聚糖凝胶色谱柱的填料由葡聚糖凝胶树脂Sephadex G-25和葡聚糖凝胶树 脂Sephadex G-50串联而成; (4)利用高效液相色谱技术将步骤(3)的粗分产物进一步分离,得到三种鳕鱼皮寡 肽。 优选地,步骤(1)中,所述蛋白酶酶解法: 将阿拉斯加狭鳕鱼皮、胰酶与水混合,在55℃、pH=6.0下酶解8h,然后再升温至90 ℃进行灭酶处理; 以阿拉斯加狭鳕鱼皮的质量计,所述胰酶的加入量为0.20wt%; 所述阿拉斯加狭鳕鱼皮与水的质量比为1:6。 采用上述优化的酶解工艺,酶解后得到的鳕鱼皮胶原肽混合肽的得率更高,可达 75.0%,经活性测试发现,该鳕鱼皮胶原肽混合肽对α-葡萄糖苷酶抑制活性IC50为50.4mg/ mL。 经测试,该酶解工艺下得到的鳕鱼皮胶原肽混合肽中: 分子质量为180~1000Da的物质占88.08%,分子质量小于180Da的物质占7.37%。 大分子蛋白质、肽和游离氨基酸含量分别为0.53g/100mL、5.20g/100mL、0.38g/ 100mL,三者的质量比为9:85:6。 4 CN 111574585 A 说 明 书 3/8 页 由此可见,得到的鳕鱼皮胶原肽混合肽主要是氨基酸残基在2~8个之间的寡肽。 优选地,步骤(2)中,所述超滤膜选自中空纤维聚砜超滤膜。 步骤(3)中,采用葡聚糖凝胶树脂串联的方式进行分离,层析柱规格为2.6×50cm, 其中上层填放葡聚糖凝胶树脂Sephadex G-25(20cm),下层填放葡聚糖凝胶树脂Sephadex G-50(15cm),中间用定量滤纸隔离。 经试验发现,本发明的分离纯化工艺中,葡聚糖凝胶色谱柱的选择尤其关键,仅有 选择葡聚糖凝胶树脂Sephadex G-25和葡聚糖凝胶树脂Sephadex G-50串联的方式才能将 超滤后分子量小于3000Da的鳕鱼皮胶原肽得到有效分离。 当采用单一的葡聚糖凝胶色谱柱时,如本发明中采用的Sephadex G-25或 Sephadex G-50,或者是采用其他种类的葡聚糖凝胶色谱柱,如Sephadex G-10与Sephadex G-15,均不能实现鳕鱼皮胶原肽的有效分离。 优选地,步骤(3)中,所述葡聚糖凝胶树脂Sephadex G-25选自100目,葡聚糖凝胶 树脂Sephadex G-50选自60目。 经进一步地试验发现,凝胶树脂粗细程度对实验结果也有影响,当采用60目的 Sephadex G-25与60目的Sephadex G-50串联使用时,也不能实现有效分离。 优选地,步骤(3)中,所述流动相的流速为0.8~1.4mL/min,进一步优选为1.2mL/ min。 经葡聚糖凝胶色谱粗分后,根据洗脱的先后顺序分离得到两个分离组分,记为分 离组分A与分离组分B。 优选地,步骤(4)中,所述高效液相色谱的分离条件为: 色谱柱:Angilent Eclipse XDB-C18柱; 流动相:A液:0.05%三氟乙酸-水溶液;B液:0.05%三氟乙酸-乙腈溶液; 采用线性梯度洗脱,0~20min,5%~20%B;20~25min,20%~100%B; 流速为1.0mL/min,柱温为30℃,检测波长为220nm。 经MALDI-TOF-MS/MS分析鉴定,采用上述分离纯化工艺制备得到的鳕鱼皮寡肽,氨 基酸序列分别为Glu-Gly-Gly-Tyr-Thr-Arg、Tyr-Val-Arg和Phe-Tyr-Glu。 经活性试验发现,以上三者的α-葡萄糖苷酶抑制活性IC50分别为5 .2mg/mL, 7.59mg/mL,13.4mg/mL。 因此,所述三种鳕鱼皮寡肽均可应用于制备ɑ-葡萄糖苷酶抑制剂。优选地,氨基酸 序列为Glu-Gly-Gly-Tyr-Thr-Arg的鳕鱼皮寡肽具有更佳的ɑ-葡萄糖苷酶抑制效果。 α-葡萄糖苷酶抑制剂作用机制为:竞争性抑制位于小肠的各种α-葡萄糖苷酶,使 淀粉类分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收,降低餐后高血糖。Ⅱ型糖 尿病是由于餐后高血糖的葡萄糖毒性可加重胰岛素抵抗及胰岛素分泌缺陷,当胰岛β细胞 功能仅剩约50%时,出现空腹血糖升高,糖耐量受损。 基于以上研究发现,本发明公开的三种鳕鱼皮寡肽还可进一步用于制备抗Ⅱ型糖 尿病药物,优选地,氨基酸序列为Glu-Gly-Gly-Tyr-Thr-Arg的鳕鱼皮寡肽具有更佳的血糖 抑制效果。 与现有技术相比较,本发明的有益效果在于: 本发明公开了三种具有新型氨基酸序列结构的鳕鱼皮寡肽; 5 CN 111574585 A 说 明 书 4/8 页 本发明针对酶解法制备的鳕鱼皮胶原肽分子量小,而且混合物的分子量集中,分 散性小的特点,采用由葡聚糖凝胶树脂Sephadex G-25和葡聚糖凝胶树脂Sephadex G-50串 联的方式对其进行粗分,再经高效液相色谱技术进一步分离,最终得到三种新型的鳕鱼皮 寡肽; 经活性试验发现,该三种鳕鱼皮寡肽具有ɑ-葡萄糖苷酶抑制活性,能辅助降血糖, 可用于制备抗Ⅱ型糖尿病药物。 附图说明 图1为实施例1中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图2为对比例1中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图3为对比例2中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图4为对比例3中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图5为对比例4中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图6为对比例5中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值; 图7为实施例2中经葡聚糖凝胶色谱柱分离得到的分离组分的洗脱曲线,横坐标为 洗脱体积(mL),纵坐标为波长为220nm处的吸光值。












