技术摘要:
本发明公开一种对X染色体多拷贝基因进行基因编辑实现动物性别控制的方法,通过筛选并选择哺乳动物X染色体上的一个或多个多拷贝基因作为靶位点并设计合成对应的sgRNA,然后通过构建靶向X染色体多拷贝基因的CRISPR/Cas9表达系统对哺乳动物精子或受精卵中的X染色体进行切 全部
背景技术:
为了满足不同的生产需求,人们渴望通过性别控制技术,大量获得所需性别的畜 禽,减少原材料的浪费。而基因编辑技术是对生物体基因组进行编辑的一种技术,可以实现 某个基因的敲除、插入和替换等,为性别控制技术的研究提供了新的方向。利用基因编辑技 术,可以建立性别相关基因的敲除系,研究其在性别分化和性腺发育中的作用,然后通过插 入外源基因增强或抑制性别相关基因的表达,以达到性别比例偏移的目的。然而,性别相关 基因的作用机制十分复杂,而且目前研究发现的性别相关基因可能并不完全,所以利用基 因编辑技术调控单一性别相关基因的性控研究大部分都未能取得理想的性控效果,即便能 获得性别比例偏移的,却也因具有生殖障碍等问题无法继续繁育。 从染色体水平分析,哺乳动物的性别主要是由XX型和XY型染色体决定的,性染色 体上也存在着许多参与性别决定与分化的基因,有目的地改变动物的染色体类型更有可能 达到性别控制的效果。正常雄性动物可以产生数量相同的两种精子分别携带着X染色体和Y 染色体,这些精子通过受精过程,在雌性动物生殖道体内完成获能,并最终与卵母细胞结 合,决定着受精卵的性别。所以利用只有一种染色体类型的精子进行受精,无疑是达到性控 目的最好办法,但是由于X精子和Y精子之间的差异并不明显,现有的技术条件做到X/Y精子 的完全分离十分困难。目前最为成熟的流式细胞仪分选技术也局限于奶牛的生产上,无法 广泛应用。 CRISPR/Cas9系统是目前最热门的一种基因编辑工具,具有特异性地切割基因组 的能力,同时在靶位点的选择上具有更高的灵活性,这让染色体的整体删除有了实现的可 能。我们可以在性染色体上的保守序列设计多个靶位点,让Cas9蛋白在sgRNA的介导下对其 进行定点切割,当切口数量超过自我修复的阈值后,便可以失活该性染色体。继而,将该切 割反应设定在雄性动物产生精子的过程中发生,那么雄性动物便只可能产生一种染色体类 型的精子。同时,由于基因编辑技术的可遗传性,性别控制的效果有可能继续存在与出生后 代的繁育中。 中国专利CN105861554B公开了一种基于对Rbmy基因进行编辑来实现动物性别控 制的方法,该方法主要通过利用CRISPR/Cas9系统特异性地切割Y染色体上的Rbmy基因,使 Rbmy基因丧失活性,进而使得Y精子或带有Y精子的受精卵丧失活性而无法发育为正常的胚 胎来提高雌性哺乳动物的出生率的。但该方法的脱靶率较高,性别控制效果有待进一步提 高。
技术实现要素:
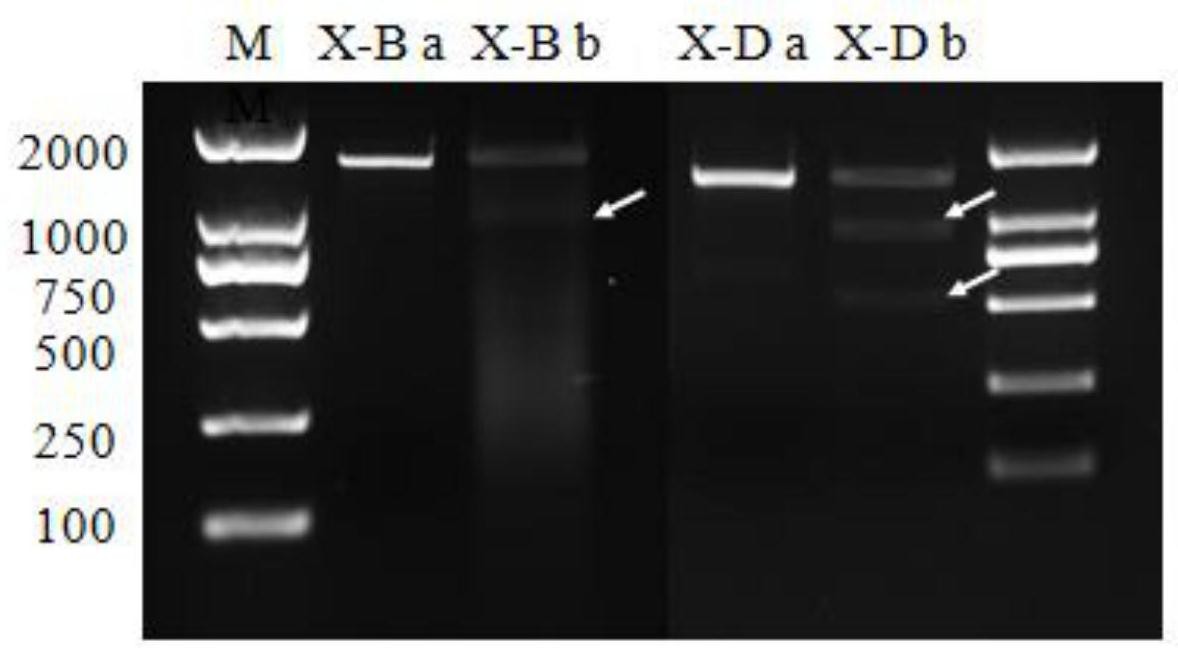
本发明的目的在于提供一种通过对X染色体上的多拷贝基因进行基因编辑来实现 3 CN 111549070 A 说 明 书 2/6 页 哺乳动物性别控制的方法。发明人通过对哺乳动物XY两条染色体进行分析,发现X染色体和 Y染色体具有不对称性,X染色体上存在一些多拷贝的性染色体特异基因,而这些多拷贝的 性染色体特异基因在Y染色体上的等位基因拷贝数较少,甚至不存在等位基因。因此,相对 于靶向Y染色体的基因编辑,靶向X染色体的基因编辑的脱靶率会更小,达到性控效果的效 率会更高。 根据本发明的一个方面,提供了一种对X染色体多拷贝基因进行编辑实现动物性 别控制的方法,其包括: 筛选并选择哺乳动物X染色体上的一个或多个多拷贝基因作为靶位点,设计对应 的sgRNA; 构建靶向X染色体多拷贝基因的CRISPR/Cas9表达系统; 将靶向X染色体多拷贝基因的CRISPR/Cas9表达系统转染或显微注射进精子中,或 显微注射进哺乳动物受精卵的雄原核中。 本发明提供的方法通过筛选并选择哺乳动物X染色体上的一个或多个多拷贝基因 作为靶位点,并通过构建靶向X染色体多拷贝基因的CRISPR/Cas9表达系统对哺乳动物的X 染色体进行切割,切割效率高,脱靶率低,可以使整条X染色体失活,并可致死X精子,显著提 高雄性哺乳动物的出生率,或者致死XY型胚胎,从而显著提高雌性哺乳动物的出生率,具有 很好的性别控制效果。 在一些实施方式中,X染色体多拷贝基因可以为X染色体上拷贝数多于10的基因, 优选为拷贝数多于50的基因。选择多拷贝基因作为靶位点的目的是要在染色体上造成尽可 能多的切口,以超过染色体自身修复能力,从而使染色体失活。 在一些实施方式中,作为靶位点的多拷贝基因可以为两个。由此,可以使靶位点在 染色体上的分布范围尽可能的广,以使对靶位点进行切割后,可以失活整条染色体。 在一些实施方式中,构建靶向X染色体多拷贝基因的CRISPR/Cas9表达系统可以包 括:将两个多拷贝基因对应的sgRNA一起构建至能表达Cas9蛋白的载体上得到共表达载体。 由此,可以避免构建和转染两个表达载体时可能出现的只转染成功一个载体或先切割其中 一个位点再切割另一个位点,导致无法失活整条染色体的现象。通过构建和转染共表达载 体,在对X染色进行切割时,可以保证同时对X染色体上的两个位点进行切割,让整条染色体 在一定时间内产生大量切口,机体无法及时修复而导致染色体失活;此外,构建和转染共表 达载体,还可以减少载体转染次数,减少对细胞的伤害。 在一些实施方式中,本发明提供的方法可以用于实现小鼠、猪、牛、羊等哺乳动物 的性别控制。 根据本发明的另一个方面,提供了一种对X染色体多拷贝基因进行编辑实现小鼠 性别控制的方法,其包括: 以小鼠X染色体上的X-B位点和X-D位点作为靶位点,设计对应的sgRNA,其中,X-B 位点的核苷酸序列包括如SEQ ID NO:1所示的核苷酸序列,所述X-D位点的核苷酸序列包括 如SEQ ID NO:2所示的核苷酸序列; 构建靶向X-B位点和X-D位点的CRISPR/Cas9表达系统; 将靶向X-B位点和X-D位点的CRISPR/Cas9表达系统转染或显微注射进小鼠精子 中,或显微注射进小鼠受精卵的雄原核中。 4 CN 111549070 A 说 明 书 3/6 页 同时选择X-B位点和X-D位点作为靶位点,可以保证X染色体上的靶位点的数量足 够多且分布范围足够广,使得对X染色体进行切割时,可以在X染色上大范围产生切口,有效 提高失活整条染色体的效果。 在一些实施方式中,X-B位点对应的sgRNA为sgRNA X-B,其核苷酸序列如SEQ ID NO:3所示;X-D位点对应的sgRNA为sgRNA X-D,其核苷酸序列如SEQ ID NO:4所示。 在一些实施方式中,构建靶向X-B位点和X-D位点的CRISPR/Cas9表达系统可以包 括: 设计并合成具有如下结构的基因片段:酶切位点I-loxP-启动子-sgRNA X-B-启动 子-sgRNA X-D-loxP2272-酶切位点II;其中,加入loxP基因有利于方便后续替换不同的 sgRNA; 将上述基因片段构建至能表达Cas9蛋白的载体上得到共表达载体。 在一些实施方式中,启动子可以选自CMV、CAG、U6、CBh中的一种或多种。 在一些实施方式中,启动子可以为U6。 在一些实施方式中,酶切位点I可以为MluI,酶切位点II可以为FseI,能表达Cas9 蛋白的载体可以为以VP12-SpCas9-HF1载体为基本骨架的表达载体。 在一些实施方式中,能表达Cas9蛋白的载体还可以包括EGFP荧光基因和Neo标记 基因的基因片段。 在一些实施方式中,将靶向X-B位点和X-D位点的CRISPR/Cas9表达系统显微注射 入小鼠受精卵的雄原核中时,共表达载体显微注射的浓度可以为5-100ng/μL,如,可以为 10ng/μL、20ng/μL、30ng/μL或50ng/μL等其他浓度。 附图说明 图1为载体一的结构图。 图2为CMV载体的结构图。 图3为载体一以及sgRNA片段合成质粒双酶切结果的电泳图;图中M1为1000 DNA marker,M2为10000 DNA Marker;a为原载体一,b为酶切后的载体一;M为10000 DNA marker;pKMV为sgRNA片段合成质粒; 图4为sgRNA X-B和sgRNA X-D介导Cas9蛋白在体外切割靶序列效率验证的电泳 图;图中a为未切割的sgRNA靶序列片段电泳结果,b为体外转录的sgRNA、靶序列以及Cas9蛋 白体外反应后的电泳结果,箭头指示为切割后片段,M为2000 DNA marker。 图5为CMV载体、空载体转染MLTC-1细胞后不同时间点的荧光效果图;图中a为 MLTC-1细胞转染CMV载体的荧光图;b为MLTC-1细胞转染空载体的荧光图。 图6为CMV载体、空载体转染MLTC-1细胞后不同时间点的绿色荧光细胞比例的结果 图。 图7为CMV载体转染MLTC-1细胞的单克隆细胞团靶位点处测序结果图;图中,WT为 靶片段X-B的理论序列,箭头指示为突变碱基。












