技术摘要:
本发明公开了人参皂苷的生物制备方法,包括:(1)通过组织培养方式诱导生产人参不定根;(2)将诱导的人参不定根转到旋转摇床中的液体培养基中培养;(3)将人参不定根从摇瓶转移到生物反应器中培养一段时间后添加茉莉酸甲酯诱导人参皂苷含量增加;(4)从诱导培养后的不定根 全部
背景技术:
人参皂苷是人参的主要药理成分,特别是稀有人参皂苷是发挥抗肿瘤、抗炎症、提 高免疫力等功能的分子。由于野生人参中皂苷含量低,稀有人参皂苷的来源极为有限,限制 了其在功能性食品和药物中的应用。 因此,在生产实践中亟待需要提供一种效率和产率高的人参皂苷的制备方法。
技术实现要素:
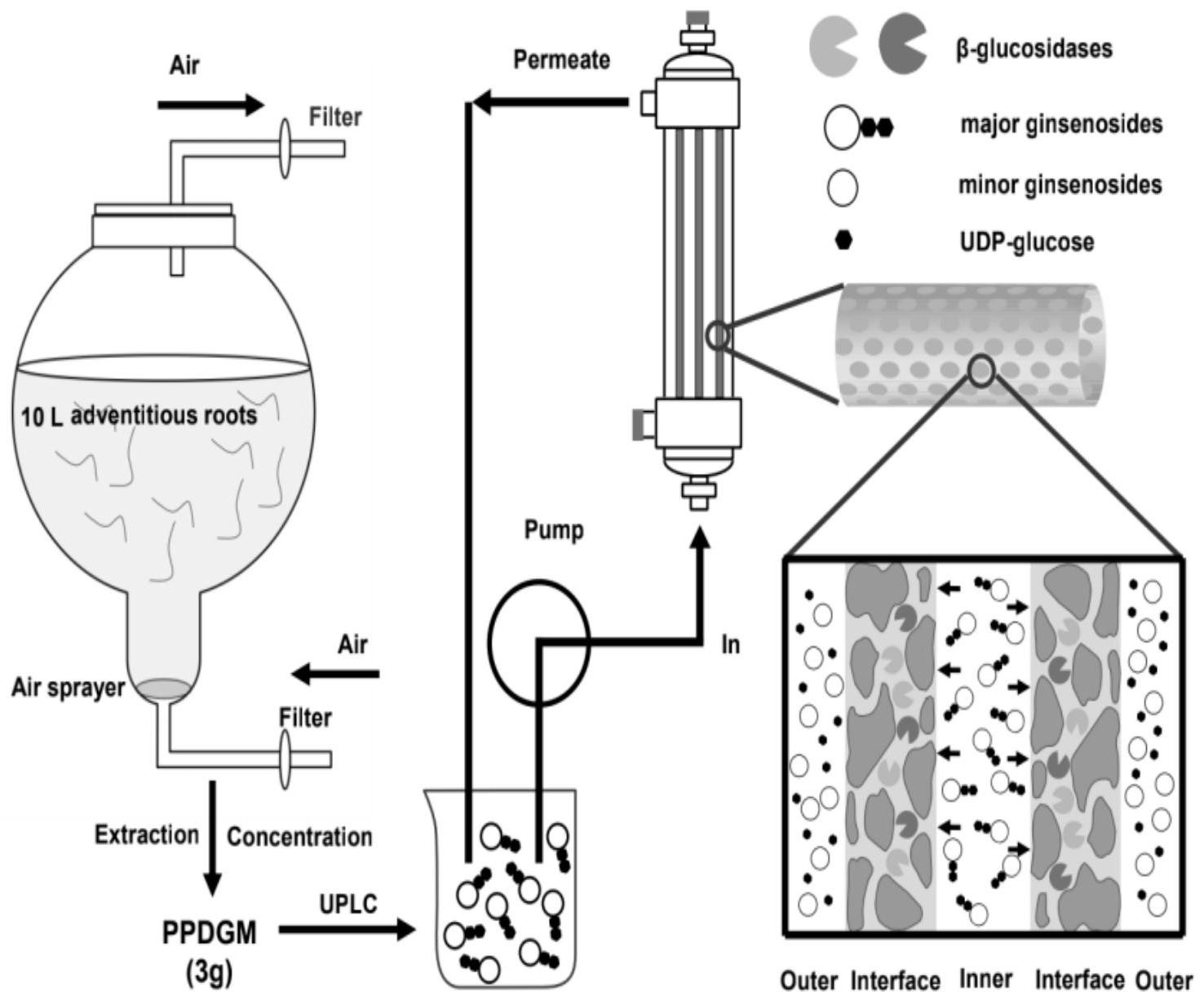
本发明的主要目的是提供一种产率高的人参皂苷的生物制备方法; 本发明的上述目的是通过以下技术方案来实现的: 一种人参皂苷的生物制备方法,包括:(1)通过组织培养方式诱导生产人参不定 根;(2)将诱导的人参不定根转到旋转摇床中的液体培养基中培养;(3)将人参不定根从摇 瓶转移到生物反应器中培养一段时间后添加茉莉酸甲酯诱导人参皂苷含量增加;(4)从诱 导培养后的不定根中提取人参皂苷。 其中,步骤(1)中所述的通过组织培养方式诱导生产人参不定根的方法包括:(a) 将人参根片接种于含1.0mg L-1 2,4-D 0.1mg L-1 kinetin 30g L-1蔗糖的诱导培养基上诱 导愈伤组织;(b)愈伤组织转移到含5.0mg L-1 IBA的MS培养基上进行愈伤组织的扩繁;(c) 在含3.0mg L-1 IBA和30g L-1蔗糖的MS固体培养基上培养愈伤组织,从愈伤组织中诱导不 定根的生成。 步骤(3)中所述添加茉莉酸甲酯是添加200μM茉莉酸甲酯以诱导人参皂苷含量增 加;优选的,将人参不定根从摇瓶转移到生物反应器中培养第50天时添加200μM茉莉酸甲酯 诱导人参皂苷含量增加。 步骤(4)中所述从人参不定根中提取人参皂苷的方法包括:(a)将人参根粉添加到 甲醇/水混合物中37℃过夜;(b)用甲醇为溶剂采用超声波仪提取:(c)将提取液的上清液过 滤除菌,蒸发去除甲醇,残渣溶解于水,即得;其中,步骤(a)中甲醇/水混合物由甲醇与水按 照4:1的体积比组成;步骤(b)中用80%甲醇为溶剂在超声波仪室温下提取3次,每次提取时 间为0.5h。 为了进一步提高不定根中的稀有人参皂苷的含量,采用β-葡萄糖苷酶作为转化酶 以从不定根中提取的人参皂苷混合液为转化底物进行酶促转化反应,转化产物中稀有人参 皂苷的含量能显著提高。 本发明发现将β-葡萄糖苷酶加入到PPD型人参皂苷混合物中进行酶促反应,能够 有效的提高转化产物中稀有人参皂苷的含量;其中,所述的β-葡萄糖苷酶优选自BglSk, BglPm,Bgp1,BglBX10,Tpebgl3或Abf22-3中的任何一种或一种以上的任意组合;其中,所述 3 CN 111575333 A 说 明 书 2/8 页 的酶促反应可以是将β-葡萄糖苷酶溶液与PPD型人参皂苷混合物在37℃的50mM磷酸钠缓冲 液(pH8.0)中进行反应。 酶促反应完成后进行UPLC分析检测人参皂苷的相对含量,并与未经处理的对照进 行了比较分析,结果发现,Bgpl、BglBX10和Abf22-3将Rd转换为Rg3,Tpebgl3将Rb1和Rd都转 换为Rg3。上述四种反应中Rg3的生成量约占PPD型人参皂苷混合物的15%~30%,Tpebgl3 在149.74±5.67mg时达到峰值。BglPm与其他四种具有C-20水解活性的酶(Bgpl、BglBX10、 Tpebgl3和Abf22-3)的所有组合酶处理产生超过40%的Rh2,以及超过10%的CMc1和CO。 BglSk与这四种酶分别组合可以产生适量的Rg3、Gyp75、CMc、CY和Rh2,比例在10%到20%之 间。BglPm和BglSk均能产生高比例的CK(277.61±4.27mg,34.22±1.91%)。在所有转化过 程中,利用BglPm Bgp1组合水解3.0g PPD型人参皂苷混合物,获得的Rh2产率最高(326.61 ±7.04mg),占PPD型人参皂苷混合物的10.89±0.23% 本发明中所述的β-葡萄糖苷酶BglSk,BglPm,Bgp1,BglBX10,Tpebgl3或Abf22-3可 通过商业化途径购买得到也可以采用本领域常规的基因工程手段制备得到重组β-葡萄糖 苷酶,均能适用于本发明。 为了提高酶的利用率和β-葡萄糖苷酶与产物的分离效率,本发明进一步将β-葡萄 糖苷酶进行固定化得到固定化的β-葡萄糖苷酶,采用固定化的β-葡萄糖苷酶进行酶促反应 能够有效的提高酶的利用率和酶以及产物的分离效率。 作为一种参考,所述的β-葡萄糖苷酶的固定化方法包括:采用分子量为30kDa的聚 砜中空纤维膜(MWCO)固定化酶。将膜在磷酸盐缓冲液(pH 8.0)中平衡30min,采用压力驱动 过滤法固定化酶;将β-葡萄糖苷酶溶液(0.5mg mL-1)用蠕动泵以10mL min-1的流速泵入通 过膜的腔中,循环2h。β-葡萄糖苷酶被包埋在不对称的、含水的多孔膜中,并被内表面的 30kDa纤维膜所固定,即得。 本发明以中空纤维膜固定化重组His-Bgp1和His-BglPm为例进行了将PPD型人参 皂苷混合物转化为Rh2的实验,验证了该方法的有效性。固定化后的β-葡萄糖苷酶具有较高 的重复利用率,在第9天进行了9个周期的重复催化反应后,其相对活性保持在85%左右。固 定化β-葡萄糖苷酶即使在连续15个周期的重复催化反应后仍能保持40%的初始活性。 本发明提供了一种组合的人参皂苷的生物制备方法,包括组织培养、酶固定化和 水解方法来获得稀有人参皂苷;本发明根据糖苷酶水解途径筛选到6种β-糖苷酶进行酶促 水解,并将它们组合使用,转化产物中稀有人参皂苷Rg3、Rh2、CK、Gyp75、CMc、CY的产量范围 为5.54-32.66mg L-1。在优化的pH和温度条件下,固定化BglPm和Bgp1可使Rh2的产率提高 7%,最高可达51.17mg L-1(PPD型人参皂苷混合物的17.06%)。本发明的生物制备方法为获 得多种稀有人参皂苷提供了一种高效的途径,可以替代直接从人参中提取人参皂苷的方 法。 附图说明 图1稀有人参皂苷生物转化系统示意图。 图2糖苷酶转化PPD型人参皂苷的生物转化途径。 图3在生物反应器中培养人参不定根有效生产人参皂苷;(A)人参不定根接种在固 体增殖培养基上生长;(B)不定根在固体培养基上生长1个月的增殖情况;(C)不定根在液体 4 CN 111575333 A 说 明 书 3/8 页 培养基中进一步培养7天;(D)不定根扩大到10L生物反应器并生长2个月;(E)不定根和5年 生野生人参根中大量人参皂苷的含量。 图4纯化后糖苷酶SDS-PAGE结果图。 图5糖苷酶最适条件温度与pH等高线图。 图6糖苷酶组合处理PPD型人参皂苷混合物24小时的转化的UPLC分析。 图7糖苷酶转化反应中PPD型人参皂苷的相对含量的热图。 图8所有糖苷酶组合中每种稀有的人参皂苷产量。 图9固定化β-葡萄糖苷酶的负载效率和热稳定性。(A)将Bglpm和Bgp1固定在中空 纤维柱上;(B)固定化Bgp1和BglPm的储存稳定性测定。 图10β-葡萄糖苷酶Bgp1和BglPm组合转化PPD型人参皂苷混合物的UPLC结果。












