技术摘要:
本发明提供了POLR2A抑制剂在制备药物中的应用,所述药物用于下述至少之一:抑制破骨细胞生成;抑制骨吸收;增加骨量;增加骨稳定性。破骨细胞从小鼠骨髓前体和人外周血单核细胞(hPBMN)的分化被si‑POLR2A抑制,但被Flag‑POLR2A增强,表明POLR2A对小鼠骨吸收的调节可能 全部
背景技术:
骨质疏松症(Osteoporosis,OP)是一个主要的公共卫生问题,发病率逐渐增加。其 特征是成骨细胞骨形成和破骨细胞骨吸收不平衡。这会导致骨骼微结构紊乱,导致骨骼稳 定性降低,骨折风险增加。慢性炎性疾病、各种药物治疗(其中包括糖皮质激素)、缺乏体力 活动和残疾等情况会影响全身骨转换,导致骨质疏松症。然而,骨质疏松症的主要原因是雌 激素缺乏。更年期后女性雌激素的丧失经常促进破骨细胞骨吸收的激活,导致骨质疏松。 雌激素治疗改善绝经后骨质疏松症已被广泛应用。然而,据报道服用雌激素会增 加心血管事件和乳腺和子宫致癌的风险。另外,雌激素的病理机制还不完全清楚。然而,有 充分的证据表明,由于破骨细胞活性增强而增加的骨吸收是这种疾病的特征。因此,了解雌 激素丢失后破骨细胞的激活对开发安全的治疗试剂至关重要。
技术实现要素:
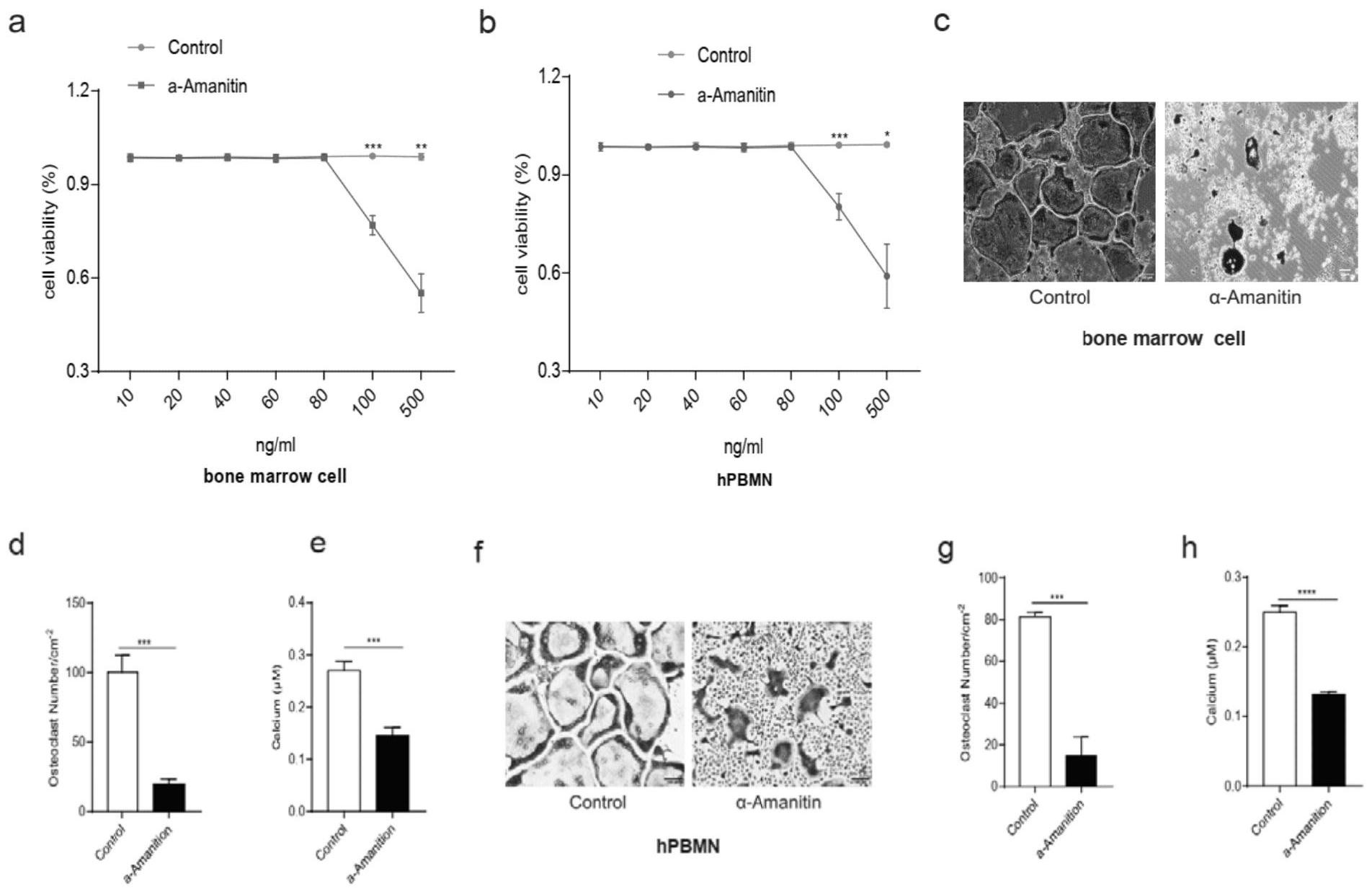
本发明的目的在于提供POLR2A抑制剂在制备药物中的应用、一种筛选药物的方 法、试剂在制备试剂盒中的应用、一种制备骨质疏松动物模型的方法。 为实现以上目的,本发明提供以下技术方案。 本发明第一方面提供POLR2A抑制剂在制备药物中的应用,所述药物用于下述至少 之一: 抑制破骨细胞生成; 抑制骨吸收; 增加骨量; 增加骨稳定性。 作为上述技术方案的进一步改进,所述药物用于预防或治疗骨质疏松。 作为上述技术方案的进一步改进,所述骨质疏松为绝经后骨质疏松。 作为上述技术方案的进一步改进,所述POLR2A抑制剂包括下述至少一种: 特异性抑制POLR2A的化合物; 特异性干扰POLR2A表达的干扰分子; 特异性敲除POLR2A的基因编辑试剂; 特异性与POLR2A编码的蛋白结合的抗体或配体。 作为上述技术方案的进一步改进,所述特异性抑制POLR2A的化合物为α- Amanitin。 作为上述技术方案的进一步改进,所述药物中α-Amanitin的含量为50μg/ml~85μ g/ml。 作为上述技术方案的进一步改进,所述特异性干扰POLR2A表达的干扰分子为 3 CN 111569076 A 说 明 书 2/7 页 siRNA。 作为上述技术方案的进一步改进,所述siRNA具有如SEQ ID NO:1~2所示的核苷 酸序列。 本发明第二方面提供一种筛选药物的方法,所述药物用于预防或治疗骨质疏松, 所述方法包括: 将候选药物用于骨质疏松模型; 定量检测用药前后骨质疏松模型的POLR2A蛋白; 用药后相比于用药前,所述骨质疏松模型的POLR2A蛋白的表达水平降低,表明所 述候选药物为目标药物。 作为上述技术方案的进一步改进,所述骨质疏松为绝经后骨质疏松。 本发明第三方面提供试剂在制备试剂盒中的应用,所述试剂用于定量检测POLR2A 蛋白表达水平,所述试剂盒用于判断药物预防或治疗骨质疏松的有效性。 作为上述技术方案的进一步改进,所述骨质疏松为绝经后骨质疏松。 本发明的有益效果: 本发明检测了POLR2A对破骨细胞增殖和分化的影响。发现在骨髓破骨细胞分化过 程中,POLR2A的表达量显著上调。POLR2A的序列在进化上是保守的,在小鼠和人类中是相同 的。破骨细胞从小鼠骨髓前体和人外周血单核细胞(hPBMN)的分化被si-POLR2A抑制,但被 Flag-POLR2A增强,表明POLR2A对小鼠骨吸收的调节可能转化为人类病理生理学。本申请的 研究表明,POLR2A-KO小鼠破骨细胞的大小、数量和核率显著降低。体内研究表明,α- Amanitin的治疗几乎完全抑制了骨吸收,增加了骨质量和稳定性。本发明对α-Amanitin的 治疗的鉴定为新一代骨保护药物的开发提供了一个全新的药物靶点以及新的治疗手段和 思路。 附图说明 为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附 图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对 本发明范围的限定。 图1为罗格列酮对破骨细胞中TRAP和POLR2A表达量的影响。 图2为破骨细胞的生长周期。 图3为敲低POLR2A对破骨细胞的影响。a~c为qRT-PCR和Western blot(n=6)检测 表达si-scramble或si-POLR2A的POLR2A的相对表达水平:a为mRNA水平、b为蛋白水平、c为 Western blot结果的统计分析;d~e为TRAP染色(n=6)检测敲低POLR2A基因后破骨细胞的 分化情况:d为TRAP染色图、e为成熟破骨细胞数量统计图、f为成熟破骨细胞活性统计图。 图4为过表达POLR2A对破骨细胞的影响。a~c为qRT-PCR和Western blot检测表达 Flag-Ctrl或Flag-POLR2A的POLR2A的相对表达水平:a为Flag-Ctrl和Flag-POLR2A的mRNA 水平、b为Flag-Ctrl和Flag-POLR2A蛋白水平、c为Western blot结果的统计分析,POLR2A蛋 白水平标准化为GAPDH蛋白水平。d~f为TRAP染色(n=6)检测过表达POLR2A基因的破骨细 胞分化:d为TRAP染色图、e为成熟破骨细胞数量统计图、f为成熟破骨细胞活性统计图。 图5为α-Amanitin抑制破骨细胞分化(体外实验)。a~b,用MTT试剂盒检测不同浓 4 CN 111569076 A 说 明 书 3/7 页 度α-Amanitin(骨髓破骨细胞和hPBMN)的细胞毒性,从左到右:骨髓6破骨细胞,hPBMN。c, TRAP染色图像(n=8)。d~e,破骨细胞数量和活性的统计图(n=8)。f,TRAP染色(hPBMN)图 像。g~h,破骨细胞数量和活性的统计图。 图6为α-Amanitin抑制绝经后骨质疏松症。a~b,Sham/Control、Sham/α- Amanitin、Ovx/Control和Ovx/Control组(n=8)肾和肝组织代表性HE染色图。c,血清CTX-1 的表达水平(n=8)。d,股骨远端图像(成像条件:90kv,80μa,fov 4.5m m,分辨率8.8μm)。e, 小梁骨参数,BV/TV:骨体积/组织体积比;BS/BV:骨表面/骨体积比;Tb.Th:骨小梁厚度; Tb.Sp:骨小梁分离;Conn.D.:连接密度;SMI:结构模型指数。f,皮质BV/TV。












