技术摘要:
本发明公开了一种基于3D打印的微元件的核酸提取系统和方法,属于核酸提取技术领域。一种基于3D打印微元件的核酸提取系统,通过3D打印技术制备具有“伞”型结构的微元件,所述微元件包括核酸结合区和手柄区;所述核酸结合区的材质包括光敏树脂和热塑性塑料。一种基于3D 全部
背景技术:
基因是遗传的主要功能单位,它们所包含的核酸碱基的特定序列能够编码生物体 功能所需的大部分蛋白质。作为基因的载体,基于核酸的体外分子检测技术,成为强大的生 物学研究工具。从生物体中提取核酸,需要将核酸从含有蛋白质、多糖和脂肪等多种生物大 分子的复杂体系中进行分离、纯化,是PCR、测序等生物学分析的先决条件。核酸提取的质 量,显著影响后续分析的准确性和灵敏度。生物样本中残留的抑制性成分(血红素、球蛋白 等成分)及分离、纯化过程中残留的有机物和盐分,是影响PCR灵敏性和分析稳健性的重要 因素。 传统的核酸的分离方法是基于有机溶剂萃取的液相分离,如Chomczynski’s法,碱 性裂解法、酚氯抽提方法、溴化乙锭-氯化钙梯度离心法等。液相分离方法虽然有效,但存在 着很大的局限性:所需样品量大、分离时间长、易受污染、降解率高。另外,液相分离方法中 有机溶剂的残留显著增加了PCR抑制剂的残留风险。为了提高提取核酸样品的纯度与浓度, 核酸的提取方法也在不断更新,目前固相萃取核酸的方法受到更多学者的青睐。固相萃取 核酸的方法主要是采用一些对核酸有结合作用的聚合物材料,在一定条件下结合核酸然后 又在适当条件下脱附,实现核酸的分离。与液相萃取方法相比,固相萃取方法减少了有机溶 剂的使用,操作相对简便,分离时间短,样品在实验过程中不易污染与降解,提取的核酸无 论是浓度还是纯度都相对较高。 固相核酸分离方法主要是基于一些对核酸有吸附作用的聚合物材料。随着磁性材 料的发展,以磁性颗粒作为核酸结合载体的磁力分离,因具备与核酸结合后能够在外加磁 场快速移动的特点,成为如今主要的核酸固相分离手段。磁力分离虽然避免传统核酸分离 过程中的繁琐离心操作,市售商业化磁力分离也通常只需要15min左右(有文献报道为 14.5min:Zou Y,Mason MG,Wang Y,Wee E,Turni C,Blackall PJ ,et al.(2017)Nucleic acid purification from plants ,animals and microbes in under 30seconds .PLoS Biol 15(11):e2003916.),且具有下游高通量和自动化应用的前景,但是,磁力分离难以避 免多次移液操作,需要依赖多联移液器,手动操作时,容易产生误差。同时,有报道指出,磁 力分离中普遍存在颗粒材料解吸核酸困难、DNA提取效率偏低等问题,限制了磁力分离的发 展与应用。虽然有报道指出,通过将磁性纳米粒子与DNA的复合物直接作为PCR模板可以避 免这个问题,但磁性颗粒对PCR扩增过程具有强抑制作用,洗脱过程不可避免。此外,磁性纳 米颗粒固有的团聚、沉降等现象,在高通量平行处理批量样本时,在很大程度上会影响分离 过程的稳定性。磁力分离中,因为纳米颗粒沉降现象,核酸与磁性纳米颗粒不能充分结合而 影响提取产率;因为纳米颗粒团聚则可能会引起清洗不完全与杂质包裹,影响磁力分离的 提取质量。 4 CN 111607489 A 说 明 书 2/8 页 相比磁力分离,基于非磁性材料的核酸固相分离发展较为缓慢。现行非磁力固相 分离多需要通过过滤、离心、移液等繁琐操作才能将结合有核酸的非磁性固相材料从裂解 液中分离出来,相比于借助外加磁场即能快速移动并实现核酸分离的磁力分离而言,往往 需要更多、更密集的人力操作,效率和通量都较为低下,下游应用受阻,是制约非磁力固相 分离发展和应用的关键瓶颈。 3D打印技术作为近年来快速发展的界面材料构筑技术,借助其在亚毫米,微米尺 度的高加工精度的特点,能够实现灵活的结构设计、优异的成型效果的目标。
技术实现要素:
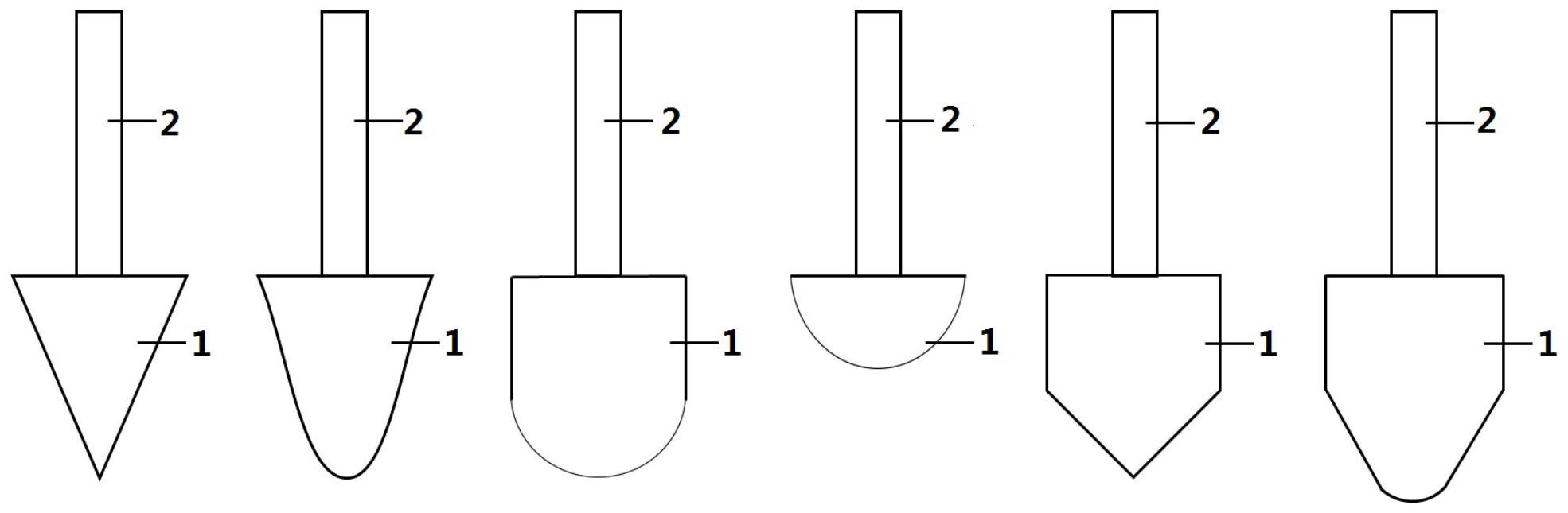
本发明利用3D打印加工精度高的优势,针对非磁力固相分离中普遍存在依赖过 滤、离心、移液等繁琐操作、通量低且难以实现自动化的瓶颈问题,本发明提供一种基于3D 打印微元件的核酸提取系统和方法。 本发明的技术方案: 一种基于3D打印微元件的核酸提取系统,所述基于3D打印微元件的核酸提取系统 为使用3D打印技术制备的具有“伞”型结构的核酸提取微元件,包括核酸结合区和手柄区, 所述核酸结合区的材质包括光敏树脂或热塑性塑料。 3D打印微元件通过软件对微元件进行结构的设计、绘制及设置,优选的,采用3D MAX软件进行结构的设计、绘制及设置。 进一步地,上述技术方案中,所述的3D打印技术包括:FDM熔融沉积成型3D打印技 术、SLA光固化快速成型3D打印技术、DLP数码影像投射3D打印技术、SLS选择性激光烧结3D 打印技术。 进一步地,上述技术方案中,所述光敏树脂包括聚丙烯酸PAA、聚乙二醇二丙烯酸 酯PEGDA、聚碳酸酯。 进一步地,上述技术方案中,所述3D打印微元件的核酸提取系统包括一个或至少 两个单体3D打印微元件;所述的3D打印微元件由至少两个单体3D打印微元件组成时,至少 两个单体3D打印微元件远离核酸结合区的手柄区端并排连接在连接区上;优选的,将8个单 体3D打印微元件的手柄顶端通过连接区并排连接,形成如图3所示的匹配8联排管使用的特 形微元件;或者进一步,将96个或384个单体3D打印微元件的手柄区端连接、排布在连接区 上,匹配96孔板和384孔板使用。 所述单体3D打印微元件由核酸结合区和手柄区组成,核酸结合区包括a型、b型、c 型、d型、e型、f型,其中a型为圆锥体状,圆锥体底面中心位置与手柄区结合;b型为类圆锥体 状,圆锥体顶点圆滑处理,圆锥体底面中心位置与手柄区结合;c型为圆柱体状与半球体状 结合,圆柱体直径与半球体直径相同,圆柱体一端底面中心位置与手柄区结合,另一端底面 与半球体最大直径面结合;d型为半球体状,半球体最大直径面的中心位置与手柄区结合;e 型为圆柱体与圆锥体结合,圆柱体的直径与圆锥体底面直径相同,圆柱体一端中心位置与 手柄区结合,另一端与圆锥体底面结合;f型为圆柱体与类圆锥体结合,圆柱体的直径与类 圆锥体的底面直径相同,圆柱体一端中心位置与手柄区结合,另一端与类圆锥体底面结合, 类圆锥体顶点圆滑化处理。 所述核酸结合区的尺寸随匹配的目标EP管的尺寸变化,优选的,匹配0.2ml EP管 5 CN 111607489 A 说 明 书 3/8 页 使用的微元件,核酸结合区的尺寸为:2-5mm(宽)×5-20mm(高);匹配0.5ml EP管使用的微 元件,核酸结合区的尺寸为:2-6mm(宽)×5-26mm(高);匹配1.5/2ml EP管使用的微元件,核 酸结合区3-9mm(宽)×5-35mm(高);核酸结合区底部为半球状的圆柱体,优选的,匹配1.5/ 2ml EP管使用的,半球状的高度为2-4mm,直径为7-8mm,圆柱体部分直径为7-8mm,高度为0- 10mm。 进一步地,上述技术方案中,所述核酸结合区的表面光滑或粗糙,且具备或不具备 微观结构;所述微观结构包括螺纹结构、凹槽结构、多孔结构、孔道结构、粗糙纹路、凸起结 构中的一种或多种结构;所述螺纹结构和凹槽结构可以设置0个或至少1个;所述粗糙纹路 可以是任意形状;所述多孔结构、孔道结构和凸起结构包括纳米尺寸、微米尺寸;凹槽结构 和凸起结构的形状可以是任何形状,包括球体、正方体、长方体、梯形或不规则形状;所述微 观结构可以分布在核酸结合区任意部位,当微观结构种类大于1个时,可以以任何方式组 合、排布。 进一步地,上述技术方案中,所述手柄区的形状包括圆柱体、立方体,所述3D打印 微元件的核酸提取系统匹配EP管使用,当3D打印微元件的核酸提取系统置于EP管内后,手 柄区露出EP管部分高度不低于3mm;优选的,匹配单个0.2-2ml离心管使用的,微元件的尺 寸:手柄b的高度为5mm-40mm;圆柱体的直径为2-5mm,长方体的长度为2-5mm,宽度为1-5mm。 所述手柄区的材质包括光敏树脂或热塑性塑料,手柄区与核酸结合区的材质相同或不同。 进一步地,上述技术方案中,所述连接区的材质可以是任意材质和任意结构,当所 述连接区为通过3D打印技术完成时,材质包括光敏树脂或热塑性塑料,和核酸结合区、手柄 区相同或不同;当所述连接区不依赖3D打印时,为可以固定、排布若干个3D单体3D打印微元 件的、有一定刚性的结构。 所述连接区、手柄区、核酸结合区通过3D打印技术一体制备或者分体制备,当为分 体制备时,通过粘合组装或者卡扣方式组装。 进一步地,上述技术方案中,所述核酸结合区上负载或不负载功能基团或颗粒材 料,所述功能基团包括氨基、羧基、羟基;所述颗粒材料包括无机颗粒材料或金属颗粒材料, 所述无机颗粒材料包括二氧化硅、二氧化钛、二氧化锰、四氧化三铁、氧化石墨烯、碳等;所 述金属颗粒材料包括金、银等。当所述核酸结合区负载功能基团或颗粒材料时,通过在核酸 结合区的材料中混合具有所述功能基团的化合物或所述颗粒材料,通过3D打印技术制备。 本发明还提供了一种基于3D打印微元件的核酸提取系统的核酸提取方法,包括如 下步骤: (1)将3D打印微元件的核酸结合区伸入含有目标核酸的溶液中,进行核酸的结合; (2)通过手持或机器持完成步骤(1)的3D打印微元件的手柄区或连接区,移动3D打 印微元件,使3D打印微元件的核酸结合区伸入清洗液中,进行核酸的清洗; (3)将完成步骤(2)的3D打印微元件取出、进行干燥; (4)通过手持或机器持将完成步骤(3)的3D打印微元件的手柄区或连接区,使3D打 印微元件的核酸结合区置入洗脱液中,进行核酸的洗脱,所得洗脱液即为目标核酸提取液。 进一步地,上述技术方案中,步骤(1)中,所述将3D打印的微元件放入含有目标核 酸的溶液中,所述目标核酸可以是RNA、基因组DNA或质粒DNA的一种或多种混合物;所述含 有目标核酸的溶液,可以是单一成分或者多成分的任意来源的任意溶液、使用裂解液对生 6 CN 111607489 A 说 明 书 4/8 页 物样本进行裂解而来的体系、或含有目标核酸的混合溶液或者单一成分溶液。 所述裂解液是指能将样本中核酸释放到溶液中的缓冲液,所述裂解液包括:CTAB 裂解液、NaHCO3裂解液、Chelex裂解液、蛋白酶K裂解液、SDS裂解液或Trizol裂解液等。所述 CTAB裂解液包括:1-3wt%的CTAB、0.5~5M NaCl、0.01~0.05M EDTA、0.05~0.5M Tris- HCl、0.05~0.5%的巯基乙醇,所述NaHCO3裂解液包括:0.05-1 .00M的NaHCO3、0.5~10% SDS,所述Chelex裂解液包括:0.5~20%的Chelex-100和0.2~5M的DTT,所述蛋白酶K裂解 液包括:20~500mmol的Tris-HCl、10~50mmol的EDTA、100~1000mmol的NaCl,0.1~10%的 SDS,和5~30μg/mL的蛋白酶K;所述SDS裂解液包括:0.5~20%的SDS,0~30μg/mL的蛋白酶 K;所述Trizol裂解液为包含Trizol的市售或者自主配置的溶液。所述裂解液中加入或不加 入RNA消化酶或者DNA消化酶,所述裂解包括震荡、混匀操作。所述裂解处理时间为1min- 24h,处理温度为-20~100℃。 所述生物样本包括动物样本或植物样本,包括血液、动植物组织或者混合物;所述 血液包括液体全血、血细胞溶液、干血斑样本;所述动物组织可以动物身体的任意部位和任 意器官;所述植物组织包括植物的任意部位的任意组分。 步骤(1)所述进行核酸的结合,具体为,将3D打印微元件的结合区伸入目标核酸的 混合溶液中,加入或不加入辅助结合溶剂,所述辅助结合溶剂包括异丙醇、无水乙醇的一种 或两者的混合溶液,所述辅助结合溶剂的体积为裂解液体积的0.6~0.8倍;结合时间为5s ~24h; 步骤(2)所述的进行核酸的清洗,进行1-5次;清洗时间为每次2s-1min; 步骤(3)所述的干燥可在室温或加热下进行,干燥时间为1min-24h; 步骤(4)所述的洗脱液是能将结合在3D打印微元件上的核酸脱离的溶液,包括水、 PBS缓冲液、TE缓冲液和下游PCR反应液;洗脱时间为5s-5min;。 发明有益效果 1.本发明首次公开了一种3D打印的微元件用于核酸提取的系统和方法,是一种非 磁力核酸固相提取技术。固相核酸分离技术中,磁力分离被普遍认为快速且具有高通量,通 常只需要15min左右。而本发明所述核酸提取方法可以获得比磁力分离更快的分离速度、更 简单的操作过程和更稳定的分离效果。利用3D打印微元件进行核酸的分离,30s内可以完成 核酸的结合与清洗,且不需要移液、离心、过滤等操作;同时,采用3D打印微元件完全不存在 因磁珠颗粒沉降、聚集等问题引起的核酸结合不充分和杂质包裹等问题,有效保障了核酸 提取的稳定性和质量;本发明突破了现行核酸固相提取中的瓶颈问题,是本发明重要的创 新点之一。 2.本发明公开的3D打印微元件的核酸提取系统具有高通量、高效率优势。当3D打 印微元件包含8个、96个、甚至384个匹配0.2mL离心管使用的单体3D打印微元件时,通过连 接区的连接、排布可以匹配8联排管、96孔板和384孔板使用,平行完成多个核酸样本的分 离,显著提高提取通量和效率,是本发明的另一个创新点。 3.本发明公开的基于3D打印微元件的核酸提取系统和方法具有自动化应用前景。 本发明方法不依赖离心、移液等繁琐操作,通过设计自动化设备代替人工,通过机器持微元 件在不同溶液之间转移,即可以实现自动化核酸提取,是本发明的另一个创新点。 4.本发明公开的基于3D打印微元件的核酸提取系统和方法具有高度的调整灵活 7 CN 111607489 A 说 明 书 5/8 页 性。首先,可以依据下游生物分子技术应用的不同需求,通过设置参数,得到不同尺寸、不同 形状的微元件,匹配不同型号、规格的离心管使用,灵活满足应用需求;其次,通过调整微元 件核酸结合区的结构设计、官能团修饰、颗粒负载等,可以调整3D打印微元件的核酸分离效 率及选择性。 5.本发明公开的基于3D打印微元件的核酸提取系统和方法,成本低、使用灵活度 高。3D打印原材料便宜、易得,打印过程方便、快速,能显著降低了经济成本;整个核酸提取 过程能够在1m2的操作环境下完成,节约空间,且不依赖电器、移液器等装备,装备需求低、 使用灵活性高。 附图说明 图1为本发明优选的3D打印微元件的结构示意图。 图2为本发明实施例1制备的微元件的结构示意图;图2(a)至图2(h)分别为3D打印 微元件1-8。 图3为本发明实施例4的3D打印特形微元件的结构示意图。 图4为本发明实施例4的琼脂凝胶电泳图;泳道1为阴性参照,泳道2-9为8例样本,M 为DL2000 marker。 图中,1、核酸结合区;2、手柄区;3、连接区。












