技术摘要:
本发明提供了一种嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞,包括胞外段结构、人的CD28跨膜序列、胞内段结构;所述的胞外段结构由信号肽序列、优化的CSPG4单链抗体序列、人免疫球蛋白G2突变序列为铰链区的序列依次串联构成;所述的优化的CSPG4单链抗体的基因序列如SEQ I 全部
背景技术:
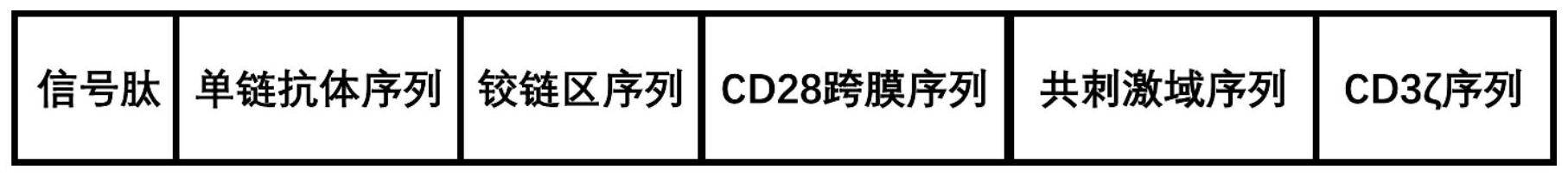
头颈部癌是指原发于上呼吸消化道包括鼻腔、副鼻窦、口腔、咽腔(包括鼻咽、口 咽、喉咽)以及喉等部位的上皮源性恶性肿瘤。头颈部癌是人类常见的恶性肿瘤之一, 发病 率居所有恶性肿瘤第6位,多发于男性,且与年龄相关,好发于60岁以上人群。 美国的最新 肿瘤统计发现最近1年新发头颈癌约6.8万例,其中70.4%为男性。而在我 国,每年约有13 万例头颈癌新发,并有约7万例患者因头颈癌死亡。头颈癌病理类型 主要为鳞癌,占95%以 上,因此头颈部癌中绝大多数均是头颈部鳞状细胞癌(HNSCC), 而HNSCC也成为头颈部癌的 主要研究对象。外科手术、放化疗仍是目前HNSCC治疗的主 要方法。但由于头颈部重要血管 神经密集,手术难度大,而放化疗对正常组织损伤大, 且存在耐药复发的难题,目前总体的 治疗效果仍不理想,5年生存率仅50%左右。与此 同时,患者对术后生活质量的要求不断提 升,疗效显著而副作用低的治疗手段亟待开发。 免疫治疗是肿瘤的第四大疗法,是指通过相应的免疫学手段来提高免疫效应细胞 如 自然杀伤细胞、CD8 T细胞等对肿瘤细胞的特异性识别和杀伤作用,最终达到治疗肿瘤 的目的。肿瘤免疫治疗不会产生类似放化疗后的耐药性,而且疗效持久甚至有免疫记忆 功 能,还可以根据肿瘤患者特定的自身条件设计特异性的靶向治疗,契合精准治疗的理 念。 肿瘤免疫治疗主要包括单克隆抗体治疗、T细胞疗法、肿瘤疫苗疗法、细胞因子疗 法等,其 中单克隆抗体和T细胞疗法在肿瘤治疗中表现出的优越性使其越来越受到重 视,有成为肿 瘤一线治疗的潜力。 嵌合抗原受体(CAR)T细胞疗法是目前肿瘤免疫治疗研究的热门。CAR主要由2部 分偶联形成,一段是能特异性结合肿瘤相关抗原的单链抗体(scFv),以及一个能激活 T细 胞发挥免疫效应功能的激活性受体。针对B细胞表面CD19抗原的CAR-T疗法在临 床上治疗B 细胞源性的血液肿瘤已经取得了巨大成功,但在治疗实体瘤的研究中却陷入 挣扎,其中最 主要的原因之一就是实体瘤具有高度异质性,缺乏一个稳定表达的肿瘤特 异性抗原。因 此,挖掘肿瘤特异性抗原以探索新型有效的治疗靶点,是目前所有实体瘤 包括HNSCC免疫 治疗研究的难点与关键。 硫酸软骨素蛋白多糖4(CSPG4)是一种细胞表面蛋白多糖,在正常组织细胞中的分 布中受到严格调控,主要表达于软骨等正常组织,主要功能可能与细胞的生长、迁移、 黏附 及与细胞外基质的相互作用有关。CSPG4最初是在黑色素瘤中被发现,后来研究发 现在中 枢神经系统中存在的神经-胶质细胞抗原2(NG2)是它的同源蛋白。有研究对多 种实体瘤包 括恶性黑色素瘤、乳腺癌、间皮瘤、胰腺癌、头颈鳞癌等的术后标本进行检 测,发现CSPG4在 许多患者的肿瘤中表达比正常组织明显增高,但是它在肿瘤发展中的 具体作用及机制尚 3 CN 111575241 A 说 明 书 2/16 页 不清晰。肿瘤干细胞是指肿瘤中具有自我更新能力并能产生异质性肿 瘤细胞的细胞,对肿 瘤的发生发展有着重要作用,而且对目前常用的放化疗手段不敏感, 是放化疗后肿瘤复发 的关键因素之一。有研究发现,恶性黑色素瘤、脑胶质瘤、结肠癌 的肿瘤干细胞中时常发现 有CSPG4表达,提示靶向CSPG4的治疗有可能成为杀伤肿瘤干 细胞、根治肿瘤复发的新型有 效武器。 嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞,其胞外段结构由信号肽序列、 763.74 或优化后的scFv序列、人免疫球蛋白G1(IgG1)或优化后的铰链序列串联构成;跨膜 区序列为CD28的跨膜区序列;胞内段结构由人的41BB胞内段共刺激域序列或CD28胞 内段 共刺激域序列串联人的CD3ζ胞内段序列构成。结构示意图如图12所示: 信号肽序列:MEFGLSWLFLVAILKGVQCSR(SEQ ID NO.43)。 CD28跨膜序列:FWVLVVVGGVLACYSLLVTVAFIIFWV(SEQ ID NO.44)。 CD3ζ序列:RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYN ELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO.45)。 我们首先在头颈部肿瘤组织和细胞系中检测了CSPG4的表达水平及与头颈部肿瘤 干细胞标志物CD44的关系,探索CSPG4作为头颈部癌免疫治疗靶点的可行性与价值。 同时, 目前针对CSPG4靶点设计的CSPG4.CAR T细胞已经被初步证实对多种肿瘤的细胞 系有效。 然而,目前报道的CSPG4.CAR T的疗效不够显著,结构有待优化,而且对HNSCC 的具体疗效 也尚无进一步的研究。基于以上研究报道,我们进一步设计并优化了一系列 靶向CSPG4蛋 白的CAR,并观察其对HNSCC细胞系的体内外的治疗效果。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了一种嵌合硫酸软骨素蛋白多糖4 受 体的T淋巴细胞(CSPG4.CAR-T)及其制备方法和用途,所述的这种嵌合硫酸软骨素蛋 白 多糖4受体的T淋巴细胞(CSPG4 .CAR-T)及其制备方法和用途要解决现有技术中的 针对 CSPG4靶点设计的CSPG4.CAR T细胞治疗肿瘤的效果不显著的技术问题。 本发明提供了一种嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞,包括胞外段结 构、 人的CD28跨膜序列、胞内段结构;所述的胞外段结构由信号肽序列、优化的CSPG4单 链 抗体序列、人免疫球蛋白G2突变序列为铰链区的序列依次串联构成;所述的优化的 CSPG4 单链抗体的基因序列如SEQ ID NO.33-42中任一所示;所述的铰链区的基因序列 如SEQ ID NO.31所示;所述的胞内段结构由人的CD28或41BB胞内段共刺激域序列、 人的CD3ζ胞内段 序列串联构成。 进一步的,所述的信号肽序列如SEQ ID NO.43所示。 进一步的,所述的人的CD28跨膜序列如SEQ ID NO.44所示。 进一步的,所述的人的CD3ζ胞内段序列如SEQ ID NO.45所示。 进一步的,所述的人的CD28胞内段共刺激域序列如SEQ ID NO.26所示。 进一步的,所述的人的41BB胞内段共刺激域序列如SEQ ID NO.27所示。 本发明还提供了上述一种嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞的制备方 法,包括如下步骤: 1)分别合成优化的CSPG4单链抗体序列、人免疫球蛋白G2突变序列;所述的优化 4 CN 111575241 A 说 明 书 3/16 页 的CSPG4单链抗体的基因序列如SEQ ID NO.33-42中任一所示示;所述的铰链 区的基因序 列如SEQ ID NO.31所示; 2)将优化的CSPG4单链抗体序列、人免疫球蛋白G2突变序列、人的CD28或41BB 胞 内段共刺激域序列、人的CD3ζ胞内段序列连接后克隆至载体中; 3)将人肾上皮细胞系重悬于含质量百分比浓度为10%胎牛血清的DMEM培养基中, 利用脂质体转染系统,将慢病毒包装质粒与步骤2)的载体加入至人肾上皮细 胞系培养基 中,48小时后收集细胞上清冻存在-80℃冰箱中备用; 4)将原代T细胞培养在含有质量百分比浓度为10%的胎牛血清、100U/ml的青霉素 和100μg/ml的硫酸链霉素的RPMI-1640培养基中;使用包被了抗CD3和抗CD28 抗体的磁珠 激活T细胞,共孵育后加入步骤3)制备好的慢病毒进行感染,感 染后再将细胞上清去掉并 置换成新鲜的T细胞完全培养基;培养后获得嵌合硫 酸软骨素蛋白多糖4受体的T淋巴细 胞。 本发明还提供了上述嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞在制备治疗头 颈 部肿瘤的药物中的用途。 本发明还提供了一种载体,含有胞外段结构、人的CD28跨膜序列、胞内段结构; 所 述的胞外段结构由信号肽序列、优化的CSPG4单链抗体序列、人免疫球蛋白G2突变 序列为 铰链区的序列依次串联构成;所述的优化的CSPG4单链抗体的基因序列如SEQ ID NO.33-42 中任一所示;所述的铰链区的基因序列如SEQ ID NO .31所示;所述的胞内段 结构由人的 CD28或41BB胞内段共刺激域序列、人的CD3ζ胞内段序列串联构成。 本发明还提供了一种慢病毒,含有上述的载体。 我们首先发现在许多头颈恶性肿瘤标本和细胞系中CSPG4蛋白存在高表达,靶向 CSPG4治疗头颈鳞癌具有可行性。同时,我们发现CSPG4与头颈部肿瘤干细胞标志物CD44 存 在共表达情况,提示靶向CSPG4治疗头颈鳞癌具有重要意义。 我们发现目前研究的以CSPG4单抗763.74作为单链抗体(scFv)序列,以人免疫球 蛋白G1(hIgG1)为铰链区,以CD28或者41BB胞内段序列构成CSPG4.CAR-T细胞在体 外可以 较好的杀伤CSPG4阳性的靶细胞,但在体内杀伤靶向肿瘤细胞的能力较差。 一方面,本发明通过优化CAR结构中的铰链区IgG1序列,以降低CSPG4 .CAR对IgG Fc受体(FcγR)的亲和力。我们尝试将IgG1的CH2CH3序列截除(CHC)、截短(CHS)、 替换成突 变的IgG2(CHM)或者替换成在CD44.CAR中应用的突变截短的低亲和力神经 生长因子受体 (NMS)序列,发现只有CSPG4.CHM.CAR能有效地在细胞膜表面表达CAR并 且识别CSPG4蛋白。 进一步的体内外研究证实,CSPG4.CHM.CAR-T的体内抗肿瘤活性显 著提高。 另一方面,本发明将CSPG4单抗763 .74的scFv序列进行优化,发现优化后的 CSPG4.CAR-T的同样能特异性地识别CSPG4蛋白。相较于之前以763.74为scfv的CAR-T, 这 种优化的CAR-T的自激活信号和耗竭信号显著减弱,并且在体外试验中表现出更强的 杀伤 活性。在肿瘤小鼠模型上,优化的CSPG4.CAR-T细胞能更好的控制住肿瘤的增殖, 并在肿瘤 切片中发现优化的CSPG4.CAR-T细胞能更多的浸润到肿瘤微环境中。 本发明和已有技术相比,其技术进步是显著的。本发明设计并优化了CSPG4.CAR-T 细胞,并证实了优化后的CSPG4.CAR-T细胞能在体内外有效的杀伤CSPG4阳性的肿瘤细 胞, 为临床治疗靶向治疗CSPG4阳性的实体肿瘤提供了新的方法和思路。 5 CN 111575241 A 说 明 书 4/16 页 附图说明 图1.A:Q-PCR检测头颈部肿瘤及癌旁对照组织中CSPG4 mRNA的转录水平。B:免 疫 组化检测头颈部肿瘤及癌旁对照组织中CSPG4蛋白表达水平。C:免疫组化检测头颈 部肿瘤 及头颈部炎症息肉组织中CSPG4蛋白表达水平。 图2.A:Q-PCR检测头颈部肿瘤多个细胞系和鼻咽正常鳞状上皮细胞系NP69中 CSPG4 mRNA转录水平。B:Western Blot检测头颈部肿瘤多个细胞系和鼻咽正常鳞状上 皮 细胞系NP69中CSPG4总蛋白表达水平。C:流式技术检测头颈部肿瘤多个细胞系和 鼻咽正常 鳞状上皮细胞系NP69中CSPG4蛋白在细胞膜表面的表达水平。 图3.A:TCGA大数据库分析头颈鳞癌标本中CSPG4 mRNA和CD44 mRNA转录水平 的 相关性。B:免疫荧光检测头颈肿瘤标本中CSPG4蛋白与CD44蛋白的共表达情况。C: 流式技 术检测头颈部肿瘤细胞系中CSPG4和CD44蛋白的共表达情况。 图4.A:CSPG4.IgG1.CD28.CAR和CSPG4.IgG1.41BB.CAR对靶细胞的体外杀伤试验。 B:CSPG4.IgG1.CD28.CAR和CSPG4.IgG1.41BB.CAR对靶细胞的体内杀伤试验。 图5.A:流式技术检测铰链区改造后CSPG4.CAR的表达情况。B:流式技术检测铰链 区改造后的CSPG4.CAR对CSPG4蛋白的识别能力。 图6.A:以CHM作为铰链区的CSPG4.CAR.T的体外杀伤试验。B:以CHM作为铰链区 的 CSPG4.CAR.T细胞的体内杀伤试验。 图7.流式技术检测CSPG4.CD28.CAR和CSPG4.41BB.CAR T细胞在无抗原刺激的情 况下激活相关受体CD69和ICOS及T细胞耗竭相关受体PD-1的表达。 图8.A:流式技术检测763.74ScFv序列优化以后的CSPG4.CAR的表达情况。B:流 式 技术检测ScFv序列优化以后的CSPG4.CAR对CSPG4抗原的特异性识别能力。C:流式 技术检 测ScFv序列优化以后的CSPG4.CAR的激活相关受体CD69和T细胞耗竭相关受体 PD-1的表 达。 图9.A:挑选了2个优化后的CSPG4.CAR感染人原代T细胞,流式技术检测相应原 代 T细胞激活相关受体CD69和T细胞耗竭相关受体PD-1的表达。B:优化以后的 CSPG4.CAR对靶 细胞的体外杀伤试验。C:ELISA检测优化以后的CSPG4.CAR在杀伤肿瘤 时分泌相关细胞炎 症因子的能力。 图10 .A:优化以后的CSPG4 .CAR对靶细胞的体内杀伤试验。B:优化以后的 CSPG4.CAR.T细胞治疗后荷瘤小鼠的生存曲线。 图11.A:Western Blot检测优化以后的CSPG4.CAR在静息状态下的4G10蛋白表达 水平。B:免疫荧光检测优化以后的CSPG4.CAR.T细胞治疗后肿瘤组织中的T细胞浸润 情况。 图12为嵌合硫酸软骨素蛋白多糖4受体的T淋巴细胞的结构示意图。












