技术摘要:
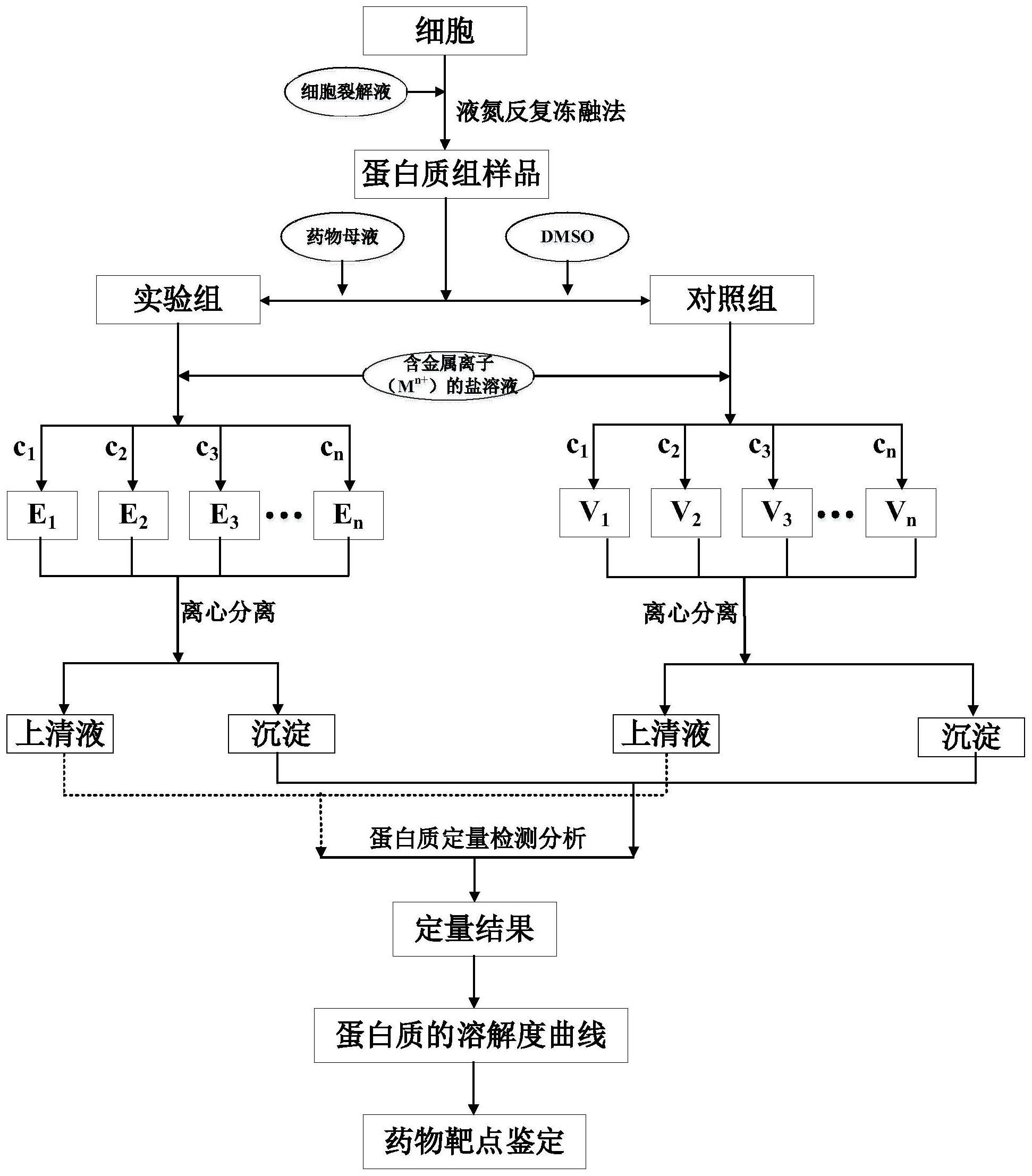
本发明提供一种鉴定药物靶蛋白的方法,其具体步骤包括:以细胞为样品,加入细胞裂解液,采用液氮反复冻融法获得细胞中的蛋白质组样品;将上述所得蛋白质组样品平均分为两份,其中一份加入一定体积一定浓度的药物母液而得到实验组样品,另一份加入等量的DMSO而得到对照 全部
背景技术:
准确识别药物的靶蛋白、揭示药物的作用和脱靶机制可以为新型药物的研发提供 关键信息,为药物在临床应用中可以更好地发挥疗效提供理论支持。 经典的药物靶蛋白鉴定方法主要包括亲和色谱法(Affinity chromatography)和 基于活性的探针分析法(Activity-based probe profiling ,ABPP)。亲和色谱法是将药物 或者具有活性的小分子固载到固体基质上,然后与细胞裂解液进行孵育来捕获与药物或小 分子有相互作用的蛋白质。这种方法比较典型的应用是通过固定非选择性激酶抑制剂 (kinobeads)进行激酶筛选来构建蛋白质激酶与抑制剂的相互作用网络。基于活性的探针 分析原理是合成同时带有反应基团和标签基团的小分子化学探针来对靶蛋白进行识别和 鉴定。由于探针与其相互作用蛋白质之间通过共价键结合,因此该方法非常适合那些与药 物亲和力很弱的靶蛋白的鉴定。但是这两种方法通常都需要对小分子药物进行化学修饰或 者衍生,这可能会导致小分子药物的结构、活性以及其与靶蛋白之间的亲和力发生改变。另 外,由于小分子药物的非特异性结合还会造成一些假阳性的鉴定结果。因此,为了减少实验 过程中由于药物修饰环节所带来的不良影响,亟需要发展无化学修饰的方法用于药物靶蛋 白的鉴定。 近年来,随着生物质谱仪和蛋白质组学技术的快速发展,一些基于蛋白质结构和 稳定性变化分析的蛋白质-药物检测策略得到了发展。如Martinez等人在2013年报道的 CETSA(Cellular thermal shift assay,CETSA)是一种的体外药物靶蛋白筛选技术,依赖 于配体可以稳定蛋白质的原理,通过监测药物结合引起的蛋白质热稳定性变化来确定药物 靶蛋白。最近Zhang等人开发了一种溶剂诱导的蛋白沉淀(Solvent-induced protein precipitation,SIP)方法在蛋白质组学层面上鉴定药物靶蛋白。该方法基于的概念是与药 物结合的蛋白质更不容易被有机溶剂变性沉淀,有助于热稳定性变化不显著的靶蛋白的发 现及鉴定。这两种技术的关键都是利用蛋白质变性沉淀的过程,通过对比药物结合前后蛋 白质分别在热稳定性和有机溶剂耐受性方面的差异来识别靶蛋白。众所周知,除了加热、有 机溶剂可以使蛋白质变性沉淀之外,金属盐也是一类非常有效的蛋白质沉淀剂,因此本发 明采用金属离子诱导蛋白质沉淀技术结合蛋白质定量分析策略,发展一种药物靶蛋白鉴定 新方法。该方法可在不对药物分子进行任何化学修饰的情况下实现对药物靶蛋白的无歧视 性、高灵敏度和高通量鉴定,为药物的作用机理和脱靶机制研究提供依据。
技术实现要素:
本发明的目的在于提供一种鉴定药物靶蛋白的方法,从而为药物作用机制研究和 新药研发提供理论依据。 一种鉴定药物靶蛋白的方法,其特征在于,所述方法包括以下步骤: 4 CN 111551749 A 说 明 书 2/5 页 (1)以细胞为样品,加入细胞裂解液,采用液氮反复冻融法获得细胞中的蛋白质组 样品; (2)分别制备实验组和对照组样品,所述实验组样品为上述步骤获得的蛋白质组 样品中加入一定体积一定浓度的药物母液于室温下旋转孵育而获得;所述对照组样品为与 实验组等量的上述步骤获得的蛋白质组样品中加入与药物母液等体积的DMSO于室温下旋 转孵育而获得; (3)使用含金属离子(Mn )的盐溶液分别对实验组和对照组样品进行处理,其特征 在于,其具体操作步骤如下: a将上述步骤中得到实验组和对照组样品各平均分为n份,编号分别为E1~En、V1~ Vn; b向E1~E 、V ~V 中分别加入含Mn n 1 n 的盐溶液,并使E1和V1中Mn 终浓度为c1 mM,E2和 V2中Mn 终浓度为c2 mM,E3和V n 3中M 终浓度为c3 mM,E 和V 中Mn n n 终浓度为cn mM,所述的处理 后的实验组和对照组样品中Mn 的终浓度c 至c n 1 n是呈递增趋势的,于室温下旋转孵育含M 的 盐溶液处理后的E1~En、V1~Vn样品; c将步骤b中得到的样品进行离心,分别收集E1~En、V1~Vn样品的上清液,备用;或 d将步骤b中得到的样品进行离心,分别收集E1~En、V1~Vn样品的沉淀部分,备用; (4)对上述步骤中得到的上清液样品或沉淀部分样品进行蛋白质定量检测分析, 得到样品中蛋白质的定量结果;和 (5)对上述步骤中的测定数据进行分析评价,其特征在于,根据蛋白质定量结果绘 制出各个蛋白质的溶解度曲线,其中实验组和对照组的溶解度曲线有显著性差异的蛋白质 即是鉴定到的药物靶蛋白。 所述细胞优选地为人肿瘤细胞。 所述细胞裂解液包括:缓冲溶液、(非离子型、离子型)表面活性剂、蛋白酶抑制剂、 磷酸酶抑制剂中的一种或几种。 所述液氮反复冻融法其具体步骤为: a收集细胞,加入预冷的裂解液在冰上裂解30min; b将a中得到的细胞裂解液转移至液氮中快速冷冻; c取出b中的样品迅速放入37℃水浴,待大部分(约60%)的样品解冻后转移至冰上 至完全解冻; d重复步骤b~c两次,在10800g、4℃条件下离心20min,取上层清液即得到细胞中 的蛋白质组样品。 所述药物优选地为抗肿瘤药物或小分子抑制剂;所述的药物母液为药物溶解于 DMSO中所得的溶液;优选地,所述药物母液的浓度为0~1M。 所述的含金属离子(Mn )的盐溶液,其金属离子(Mn )包括但不限于Ca2 、Ba2 、Cu2 、 Cd2 ,Pb2 、La3 ,Ce3 ,Er3 等;所述的盐溶液其酸根离子包括但不限于SO 2-、PO 3-4 4 、Cl-等。 所述的含Mn 的盐溶液处理后的E n 1~En、V1~Vn样品中M 的终浓度c1~cn的范围优 选为0~100mM; 所述的孵育时间优选为0~60min;离心条件优选为:离心力0~20000g,离心温度0 ~37℃,离心时间0~60min。 5 CN 111551749 A 说 明 书 3/5 页 所述蛋白质定量检测分析包括但不限于质谱分析、Western-blot分析。 所述缓冲溶液优选为PBS(pH 7 .4)、50mM Tris-HCl(pH 7 .4)或50mM HEPES(pH 7.4);所述表面活性剂优选为NP-40。 附图说明 本发明的上述及其它方面和特征将从以下结合附图对实施例的说明清楚呈现,其 中: 图1为本发明所述的药物靶蛋白鉴定方法的流程示意图; 图2显示采用图1所示的流程所获得的蛋白质Western-blot定量结果图; 图3为根据图2的蛋白质Western-blot定量结果图绘制的蛋白质溶解度曲线。












