技术摘要:
本发明提供了一种区分禽腺病毒I群四种血清型的方法,通过特异性引物来检测禽腺病毒E8a、E8b、C4和D11四种血清型。本发明的引物组合能特异地扩增出样品中的禽腺病毒的hexon片段,检测灵敏度高,结果准确。可将其应用到禽腺病毒的检测鉴定中去。本发明的引物组合能够特异 全部
背景技术:
禽腺病毒(Fowl adenovirμs,FadV)是一种无囊膜的双链DNA病毒,根据其抗原性 不同分为三个群:I群、II群和III群。其中I群禽腺病毒具有共同的群抗原,根据中和试验可 将其分为12个血清型(FadV1-12)。I群禽腺病毒的不同血清型对禽类的致病性不同,目前中 国流行株主要是是E8a、E8b、C4和D11四种,快速准确的区分鉴别这四种血清型对临床诊断 和治疗具有十分重要的意义。 唐熠等(2009)利用PCR-RFLP技术对I群禽腺病毒12个血清型毒株进行了分型鉴 定。利用两对引物对hexon基因进行PCR扩增,得到两种PCR产物,再用限制性内切酶HaeⅡ对 两种产物进行酶切,根据A片段的酶切产物和B片段的酶切产物综合分析判定血清型。 李海英等(2011)对I群禽腺病毒12个血清型毒株的hexon全基因序列进行了测定 和聚合酶链式反应限制性片段长度多态性分析(PCR-RFLP),利用三对引物对hexon全基因 进行扩增,并进行序列测序和PCR-RFLP分析,构建的进化树显示出五个主要的分支。选用限 制性内切酶HaeⅡ进行酶切,根据片段特异性能够有效区分大部分血清型。 目前国内流行最为广泛的就是禽腺病毒血清4型、E8a、E8b和D11血清型,而有的病 禽更是存在不同血清型混感的情况。但目前的鉴定方法中多是利用PCR扩增结合内切酶酶 切技术进行区分,该方法相对浪费时间和试剂,且不同血清型混感的情况更是难以区分。因 此建立一种快速、准确、敏感的多重PCR方法对于区分鉴别四种不同血清型腺病毒具有重要 意义。
技术实现要素:
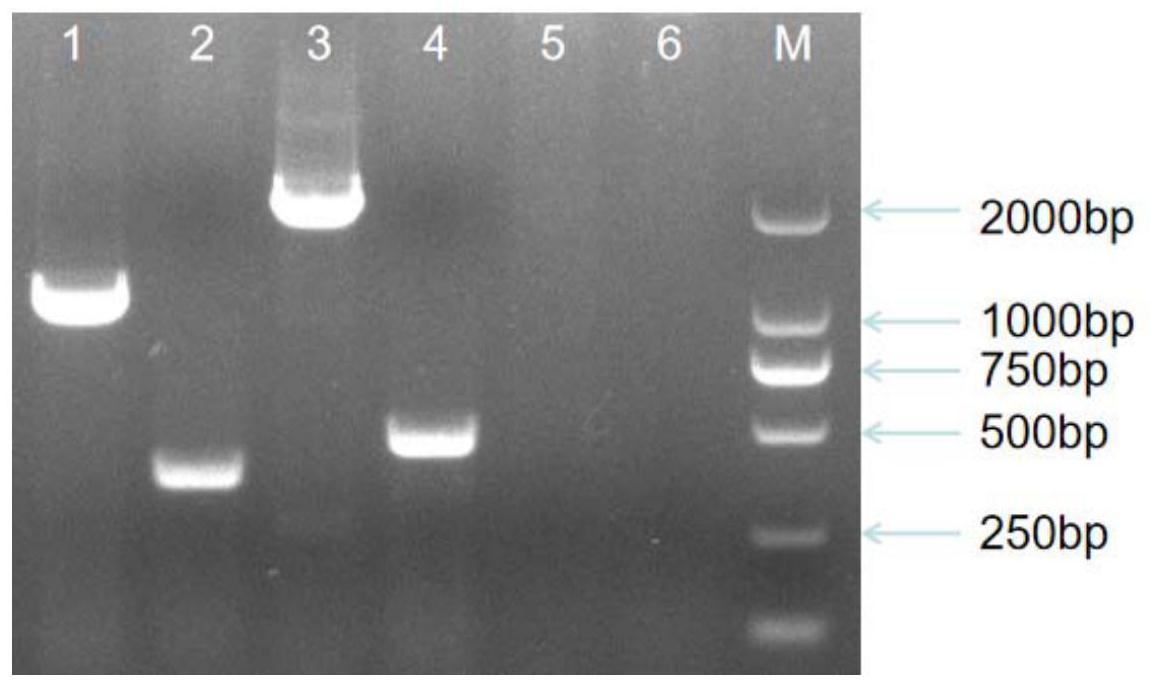
本发明提供了一种区分禽腺病毒I群四种血清型的方法,通过特异性引物来检测 禽腺病毒E8a、E8b、C4和D11四种血清型,从而弥补现有技术的不足。 本发明首先提供一种用于检测禽腺病毒E8a、E8b、C4和D11四种血清型的引物组, 所述的引物组中包含有上游引物和下游引物,其中: 上游引物FADV-F的序列为5′-GCSACYGGAAGCTACTTTGA-3′、 下游引物中: FADV-R1:5′-TTATGTACCCGTCAGCTCTGC-3′, FADV-R2:5′-TAGCTGTGTTTTGCGCCTCG-3′, FADV-R3:5′-CGAAGAGGCCGGGCAATGC-3′, FADV-R4:5′-GCTGCCGACGTCGCGTCTAA-3′; 本发明所提供的引物组用于制备检测禽腺病毒四种不同血清型的PCR扩增试剂 盒。 3 CN 111575412 A 说 明 书 2/5 页 本发明另一个方面还提供一种鉴定禽腺病毒四种不同血清型中的方法, 包括如下的步骤: 1)提取待测样品的总DNA; 2)建立PCR反应体系,以提取的DNA为模板,采用上述的引物组合进行PCR扩增; 3)对PCR产物进行凝胶电泳检测; 如果扩增产物中出现2255bp的条带,则说明样品中含有禽腺病毒C4型;如果扩增 产物中出现1125bp的条带,则说明样品中含有禽腺病毒E8a型;如果扩增产物中出现365bp 的条带,则说明样品中含有禽腺病毒E8b型;如果扩增产物中出现468bp的条带,则说明样品 中含有禽腺病毒D11型。 所述待测样品为禽类胚尿囊液或离体病理组织;作为优选,所述禽类为鸡。 所述PCR反应体系包括如下的组分:1×Additive for high Specificity,1× MightyAmp Bμffer,1.25μ/μL MightyAmp DNA Polymerase,引物混合物浓度为20μM。 所述的PCR反应的条件为:98℃预变性2min,98℃变性10s,60℃退火15s,68℃延伸 2min,32个循环,72℃延伸10min。 本发明与现有技术相比,具有以下优点: 1、本发明的引物组合能特异地扩增出样品中的禽腺病毒的hexon片段,检测灵敏 度高,结果准确。可将其应用到禽腺病毒的检测鉴定中去。 2、本发明的引物组合能够特异性地扩增出禽腺病毒I群中四种血清型,根据扩增 基因片段的大小区分四种血清型,结果快速准确,极大地降低了时间成本和试剂成本。 附图说明 图1为使用该多重引物扩增禽腺病毒阳性病料样本的PCR扩增图,其中M是DL2000 DNA Marker,1是E8a血清型阳性病料样本,2是E8b血清型阳性病料样本,3是C4血清型阳性 病料样本,4是D11血清型阳性病料样本,5和6是阴性对照。 图2是使用多重引物扩增混合毒株的电泳结果图,其中M是DL2000 DNA Marker,1 是E8a和E8b混合病料样本,2是E8a、C4混合病料样本,3是E8a、D11混合病料样本,4是E8b、C4 混合病料样本,5是E8b、D11,6是C4、D11混合病料样本,7是E8a、E8b、C4混合病料样本,8是 E8a、C4、D11混合病料样本,9是E8a、E8b、D11混合病料样本,10是E8b、C4、D11混合病料样本, 11是E8a、E8b、C4、D11混合病料样本。 图3是E8a、E8b、C4、D11血清型hexon基因同源性分析图。 图4是多重引物特异性验证电泳图。M是DL2000 DNA Marker,1是E8a阳性病料,2是 E8b阳性病料,3是C4阳性病料,4是D11阳性病料,5是EDS病料、6是ILTV病料、7是ALV病料、8 是MDV病料、9是FPV病料,10和11是阴性对照。 图5是多重引物扩增E8a毒株敏感性验证电泳图。M是DL2000 DNA Marker,1是E8a 毒株浓度为1μg/mL,2是E8a毒株浓度为10-1μg/mL,3是E8a毒株浓度为10-2μg/mL,4是E8a毒 株浓度为10-3μg/mL,5是E8a毒株浓度为10-4μg/mL,6是E8a毒株浓度为10-5μg/mL,7是E8a毒 株浓度为10-6μg/mL,8是E8a毒株浓度为10-7μg/mL,9是E8a毒株浓度为10-8μg/mL,10是E8a毒 株浓度为10-9μg/mL,11是E8a毒株浓度为10-10μg/mL。 图6是多重引物扩增E8b毒株敏感性验证电泳图,其中M是DL2000 DNA Marker,1是 4 CN 111575412 A 说 明 书 3/5 页 E8b毒株浓度为1μg/mL,2是E8b毒株浓度为10-1μg/mL,3是E8b毒株浓度为10-2μg/mL,4是E8b 毒株浓度为10-3μg/mL,5是E8b毒株浓度为10-4μg/mL,6是E8b毒株浓度为10-5μg/mL,7是E8b 毒株浓度为10-6μg/mL,8是E8b毒株浓度为10-7μg/mL,9是E8b毒株浓度为10-8μg/mL,10是E8b 毒株浓度为10-9μg/mL,11是E8b毒株浓度为10-10μg/mL。 图7是多重引物扩增C4毒株敏感性验证电泳图,其中M是DL2000 DNA Marker,1是 C4毒株浓度为1μg/mL,2是C4毒株浓度为10-1μg/mL,3是C4毒株浓度为10-2μg/mL,4是C4毒株 浓度为10-3μg/mL,5是C4毒株浓度为10-4μg/mL,6是C4毒株浓度为10-5μg/mL,7是C4毒株浓度 为10-6μg/mL,8是C4毒株浓度为10-7μg/mL,9是C4毒株浓度为10-8μg/mL,10是C4毒株浓度为 10-9μg/mL,11是C4毒株浓度为10-10μg/mL。 图8是多重引物扩增D11毒株敏感性验证电泳图,其中M是DL2000 DNA Marker,1是 D11毒株浓度为1μg/mL,2是D11毒株浓度为10-1μg/mL,3是D11毒株浓度为10-2μg/mL,4是D11 毒株浓度为10-3μg/mL,5是D11毒株浓度为10-4μg/mL,6是D11毒株浓度为10-5μg/mL,7是D11 毒株浓度为10-6μg/mL,8是D11毒株浓度为10-7μg/mL,9是D11毒株浓度为10-8μg/mL,10是D11 毒株浓度为10-9μg/mL,11是D11毒株浓度为10-10μg/mL。












