技术摘要:
本发明提供靶向羊毛硫氨酸合成酶C样蛋白质2路径的化合物。所述化合物可以用于治疗多种病状,包括传染性疾病、自身免疫性疾病、糖尿病以及慢性发炎性疾病。
背景技术:
羊毛硫氨酸C样蛋白质2(LANCL2)(也称为“羊毛硫氨酸合成酶C样蛋白质2”或“羊 毛硫氨酸合成酶组分C样蛋白质2”是所表达免疫细胞、胃肠道、神经元、睾丸和胰脏的信号 传导路径蛋白质[1]。使LANCL2路径活化增加胰岛素敏感性并且减少与各种自身免疫、发炎 性和代谢病状相关联的炎症。小鼠中体内和体外测试的结果展示,与对照组相比,使用靶向 此路径的化合物在葡萄糖耐量测试中降低葡萄糖水平2倍并且提供与处方 (英 格兰布伦特福德的葛兰素史克公司(GlaxoSmithKline plc,Brentford,England)),是有效 治疗但具有显著副作用。靶向LANCL2路径还使肠道炎症减少90%,并且使病变数量相应减 少4倍。所述路径的此测试和其它验证的结果出版于12篇同行审查的在职文章中[2-13]。 在自身免疫相关炎症的类别内,目前存在自身免疫性病症全球大流行,如发炎性 肠病(IBD)、全身性狼疮、类风湿性关节炎、1型糖尿病、牛皮癣、多发性硬化症。还存在慢性 代谢发炎性疾病大流行,包括代谢综合征、肥胖、前驱糖尿病、心血管疾病和2型糖尿病。目 前的治疗是适度有效的,但昂贵并且具有严重副作用。对自身免疫性疾病最有效的治疗(如 抗TNF抗体)的投药途径是经由IV或皮下注射,因而要求访问诊所/手术和频繁监测。LANCL2 的独特作用模式提供与抗TNF抗体同样有效但不具有副作用和高成本的口服投与的治疗 剂。鉴于发炎性和自身免疫性疾病整体的流行性,LANCL2路径具有显著影响数百万患者的 潜能。 脱落酸(“ABA”)是在原始筛选过程中发现的结合于LANCL2的一种天然化合物。 在合成有机化学领域中描述大量化合物。各种化合物由以下参考文献提供:Diana 4 CN 111592508 A 说 明 书 2/61 页 等人的WO1997/036866、Sun等人的WO 2006/053109、Kim等人的WO 2006/080821、Nunes等人 的WO 2007/019417、Singh等人的WO 2009/067600和WO 2009/067621、Adams等人的WO 2008/079277、Urasoe等人的JP 2008/056615、Stoessel等人的WO 2011/066898、 Bassaganya-Riera等人的US 2013/0142825以及Bassaganya-Riera等人的美国专利7,741, 367。已知描述于这些参考文献中的化合物中的一些使LANCL2路径活化,而另一些不使之活 化。 需要研发LANCL2路径的新颖配位体以允许治疗针对个别疾病进行特异性定制并 潜在地使其功效达到最大。 本申请因此描述一系列化合物类别,其已经通过新颖医药化学方法研发,并使用 计算机模拟、体外和体内技术筛选以使其结合于LANCL2蛋白质的能力达到最大并且因此在 各种疾病病状中实现有益反应,所述疾病病状包括(但不限于)自身免疫、慢性发炎性、代谢 和传染性疾病。
技术实现要素:
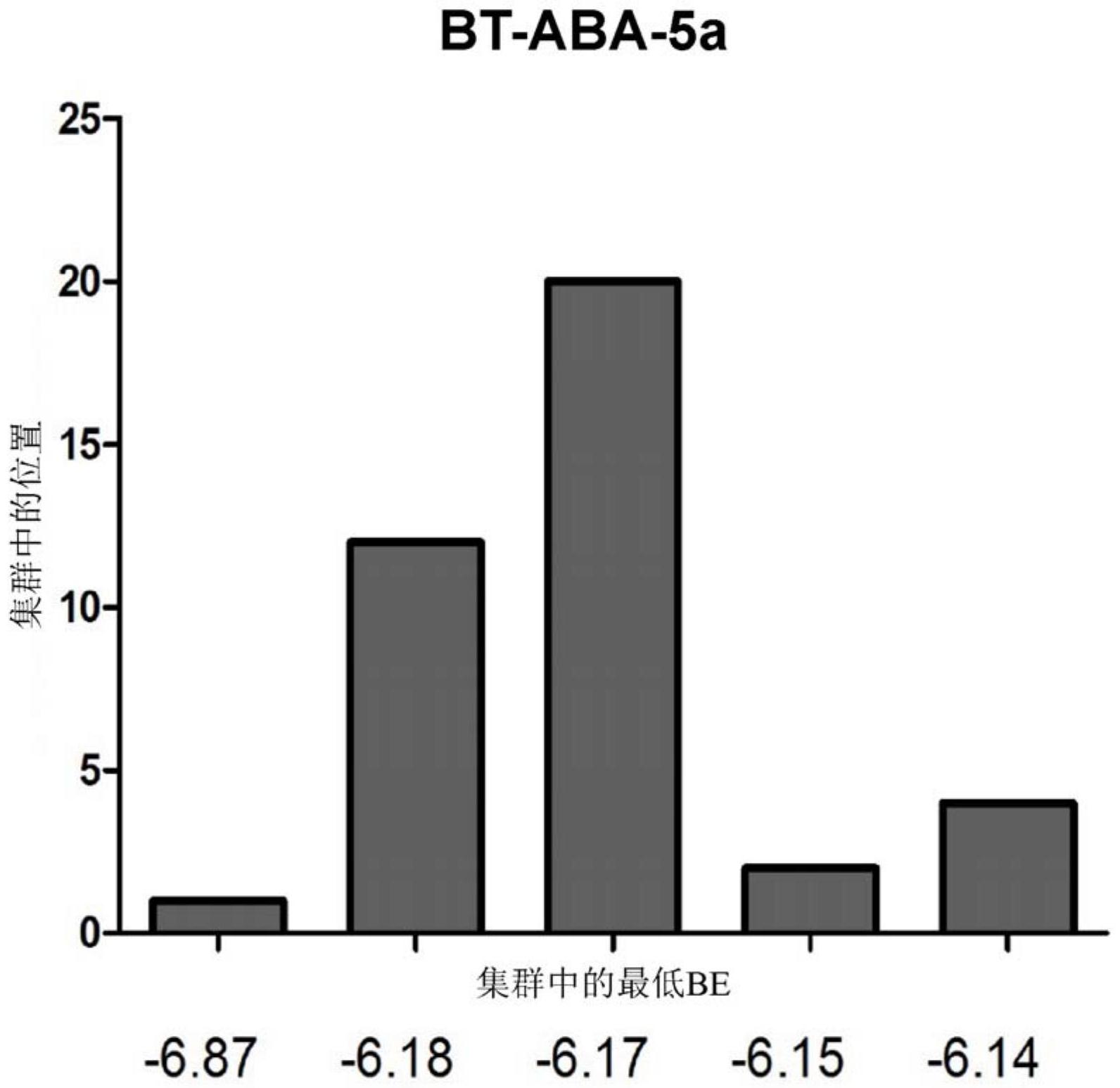
本发明提供包含式Z-Y-Q-Y'-Z'的化合物或其药学上可接受的盐或酯, 其中: Z是: Y是: Q是哌嗪-1 ,4-二基;2,5-二氮杂双环[2.2 .1]庚烷-2 ,5-二基;2,5-二氮杂双环 [2.2.2]辛烷-2,5-二基;1,4-二氮杂环庚烷-1,4-二基;苯-1,4-二胺-N1,N4-二基;乙烷-1, 2-二胺-N1,N2-二基;N1,N2-二烷基乙烷-1,2-二胺-N1,N2-二基;丙烷-1,3-二胺-N1,N3-二基; N1,N3-二烷基丙烷-1,3-二胺-N1,N3-二基;1,4-二氨基蒽-9,10-二酮-1,4-二基;C6芳烃-1, 4-二胺-N1,N4-二基,其中所述芳烃在2、3、5或6位被一个到四个取代基取代,并且其中所述 取代基独立地选自由以下组成的群组:-C(O)O(C1到C6)烷基、OH、O(C1到C6)烷基、(C1到C6)烷 基、CF3、F、Cl和Br;或被取代的哌嗪-1 ,4-二基,其中所述哌嗪在2、3、5或6位被一个到八个 取代基取代,并且其中所述取代基独立地选自由以下组成的群组:(C1到C6)烷基、芳基、芳基 (C1到C6)烷基、C(O)OH和C(O)O(C1到C6)烷基; Y'是: 5 CN 111592508 A 说 明 书 3/61 页 或单键;并且 Z'是: 或R5; 其中: 仅在Z'是R5时,Y'是单键; A1和A1'各自独立地是N、N(C1到C6)烷基、O、S或CR6; A2和A2'各自独立地是N或CR7; A3和A3'各自独立地是NR8、O或S; A4和A4'各自独立地是N或CR9; A 105和A5'各自独立地是N或CR ; A 116和A6'各自独立地是N或CR ; R1、R1'、R2、R2'、R3、R3'、R4、R4'、R5、R6、R7、R8、R9、R10和R11各自独立地选自由以下组成 的群组:氢;烷基;卤基;三氟甲基;二烷基氨基,其中每一烷基独立地加以选择;-NH2;烷基 氨基;芳基烷基;杂芳基烷基;杂环烷基;被取代的杂环烷基,其被1到2个独立地选自由以下 组成的群组的取代基取代:-C(O)OH、-C(O)O(C1到C6)烷基、(C1到C6)烷基、-CF3、F、Cl和Br;以 及被取代的杂芳基烷基; 其中所述被取代的杂芳基烷基被1到3个独立地选自由以下组成的群组的取代基 取代:-NH2;-NH(C1到C6)烷基;-N((C1到C6)烷基)2,其中每一烷基独立地加以选择;烷基;卤 基;芳基;被取代的芳基,其被1到3个独立地选自由以下组成的群组的取代基取代:- SO R12、-OR132 、-卤基、-CN、-CF3、氨基烷基-、-S(O)R14和烷基;杂环烷基;杂芳基;被取代的芳 基,其被1到3个独立地选自由以下组成的群组的取代基取代:烷基、-CF3、F、Cl和Br;烷基氨 基-;杂环烷基-烷基-氨基-;烷基氨基烷基氨基-;-NHC(O)OR15;-NHC(O)NR16R17;-C(O) NR16R17;以及被取代的杂芳基,其被1到3个选自由以下组成的群组的取代基取代:烷基、卤 基、CN、NH2、-NH(C1-C6烷基)、-N(C1-C6烷基)2(其中每一烷基独立地加以选择)、-CF3和被取 代的芳基(被1到3个独立地选自由-S(O) 152R 和-CN组成的群组的取代基取代); 其中R12、R13、R14、R15、R16和R17各自独立地选自由以下组成的群组:C1-C6烷基、包含 独立选择发C1-C6烷基的二烷基氨基、-NH2、烷基氨基、杂环烷基和被取代的杂环烷基(被一 个到两个独立地选自由-C(O)O(C1-C6烷基)和C1-C6烷基组成的群组的取代基取代)。 在一些化合物中,A3和A3'中的至少一个是O或S。在一些化合物中,A1和A1 '中的一 个或两个是N。在一些化合物中,A2和A2'中的一个或两个是CH,A3是NH,A4是N,A5是CH,并且A6 是CH。在一些化合物中,A2和A2'中的一个或两个是CH,A3和A3'中的一个或两个是NH,A4和A4' 中的一个或两个是N,A5和A5'中的一个或两个是CH,并且A6和A6'中的一个或两个是CH。在一 些化合物中,Q是哌嗪-1,4-二基;2,5-二氮杂双环[2.2.1]庚烷-2,5-二基;2,5-二氮杂双环 6 CN 111592508 A 说 明 书 4/61 页 [2.2.2]辛烷-2,5-二基;1,4-二氮杂环庚烷-1 ,4-二基;N1 ,N2-二烷基乙烷-1 ,2-二胺-N1 , N2-二基;N1,N3-二烷基丙烷-1,3-二胺-N1,N3-二基;1,4-二氨基蒽-9,10-二酮-1,4-二基;C6 芳烃-1,4-二胺-N1,N4-二基,其中所述芳烃在2、3、5或6位被一个到四个取代基取代,并且每 一取代基独立地选自由以下组成的群组:-C(O)O(C1到C6)烷基、OH、O(C1到C6)烷基、(C1到C6) 烷基、CF3、F、Cl和Br;或被取代的哌嗪-1 ,4-二基,其中所述哌嗪在2、3、5或6位被一个到八 个取代基取代,并且每一取代基独立地选自由以下组成的群组:(C1到C6)烷基、芳基、芳基 (C1到C6)烷基、C(O)OH和C(O)O(C1到C6)烷基。 在一些化合物中,式Z-Y-Q-Y'-Z'是: 或 其盐。在一些化合物中,选自由以下组成的群组的一对或多对的成员相同:A1和 A1'、A2和A2'、A3和A3'、A4和A4'、A5和A5'、A6和A6'、R1和R1'、R2和R2'、R3和R3'以及R4和R4'。在一 些化合物中,选自由以下组成的群组的一对或多对的成员不同:A1和A1'、A2和A2'、A3和A3'、 A4和A4'、A5和A5'、A6和A6'、R1和R1'、R2和R2'、R3和R3'以及R4和R4'。在一些化合物中,选自由以 下组成的群组的每一对的成员相同:A1和A1'、A2和A2'、A3和A3'、A4和A4'、A5和A5'、A6和A6'、R1 和R1'、R2和R2'、R3和R3'以及R4和R4'。在一些化合物中,选自由以下组成的群组的每一对的 成员不同:A1和A1'、A2和A2'、A3和A3'、A4和A4'、A5和A5'、A6和A6'、R1和R1'、R2和R2'、R3和R3'以 及R4和R4'。 在一些化合物中,式Z-Y-Q-Y'-Z'是: 7 CN 111592508 A 说 明 书 5/61 页 或 其盐。 本发明的一些化合物具有以下结构: 8 CN 111592508 A 说 明 书 6/61 页 或 其盐。 本发明还提供包含式A-B-C的化合物或其药学上可接受的盐或酯, 其中: A是: B是: 并且 C是: 9 CN 111592508 A 说 明 书 7/61 页 其中: A7、A8、A9、A10、A11、A12、A13和A14各自独立地选自CH、CR18和N; A15、A16、A17、A18、A19和A20各自独立地选自CH、CR19、N、NR20、O和S,其限制条件为A15、 A16和A17中的仅一个可以是N、NR20、O或S,并且A18、A19和A20中的仅一个可以是N、NR20、O或S; R18和R19各自独立地选自C1-C6烷基;C1-C6二烷基氨基,其中每一C1-C6烷基独立地 加以选择;-NH2;烷基氨基;杂环烷基;以及被取代的杂环烷基,其中所述被取代的杂环烷基 被一个到两个独立地选自由-C(O)O(C1-C6烷基)和C1-C6烷基组成的群组的取代基取代;其 中在具有超过一个CR18的化合物中,每一R18独立地加以选择,并且在具有超过一个CR19的化 合物中,每一R19独立地加以选择;并且 R20是C1-C6烷基。 在一些化合物中,B是: 一些化合物具有以下结构: 或其盐。 本发明还提供用本文所描述化合物中的任何一种或多种治疗动物中的病状的方 法。所述方法包含向动物投与有效量的本文所描述化合物中的一种或多种。所述病状可以 选自由以下组成的群组:传染性疾病、自身免疫性疾病、糖尿病以及慢性发炎性疾病。在一 些方法中,传染性疾病包含病毒性疾病,如流感感染。在一些方法中,自身免疫性疾病包含 自身免疫性发炎性疾病,如发炎性肠病,包括溃疡性结肠炎和/或克罗恩氏病(Crohn 's disease)。在一些方法中,糖尿病选自由1型糖尿病和2型糖尿病组成的群组。在一些方法 中,慢性发炎性疾病包含代谢综合征。在一些方法中,所述方法包含投与一定量的有效增加 LANCL2活性、减少炎症和/或增加抗炎作用的化合物。 本发明还提供用于用本文所描述化合物中的任何一种或多种治疗动物中的病状 的化合物。用于此类用途的化合物包括本文所描述的任何化合物。使用可以包含向动物投 10 CN 111592508 A 说 明 书 8/61 页 与有效量的本文所描述化合物中的一种或多种,其中病状选自由以下组成的群组:传染性 疾病、自身免疫性疾病、糖尿病以及慢性发炎性疾病。在一些型式中,传染性疾病包含病毒 性疾病,如流感感染。在一些型式中,自身免疫性疾病包含自身免疫性发炎性疾病,如发炎 性肠病,包括溃疡性结肠炎和/或克罗恩氏病。在一些型式中,糖尿病选自由1型糖尿病和2 型糖尿病组成的群组。在一些型式中,慢性发炎性疾病包含代谢综合征。在一些型式中,化 合物有效增加LANCL2活性、减少炎症和/或增加抗炎作用。 本发明的目标和优点将由以下结合附图进行的本发明优选实施例详细描述而表 现得更完全。 附图说明 图1A和1B.化合物与LANCL2的结合的计算性预测和使用SPR的生化实验验证。 图2.NSC6160前五个集群的群集直方图(Clustering histogram)。使用AutoDock Tools用与LANCL2对接的NSC6160执行一百次对接操作。RMSD集群容限是 结合能以kJ/ mol为单位列出。 图3.ABA前五个集群的群集直方图。使用AutoDock Tools用与LANCL2对接的ABA执 行一百次对接操作。RMSD集群容限是 结合能以kJ/mol为单位列出。 图4.BT-11前五个集群的群集直方图处理。使用AutoDock Tools用与LANCL2对接 的BT-11执行一百次对接操作。RMSD集群容限是 结合能以kJ/mol为单位列出。 图5.BT-6前五个集群的群集直方图。使用AutoDock Tools用与LANCL2对接的BT-6 执行一百次对接操作。RMSD集群容限是 结合能以kJ/mol为单位列出。 图6.BT-15前五个集群的群集直方图。使用AutoDock Tools用与LANCL2对接的BT- 15执行一百次对接操作。RMSD集群容限是 结合能以kJ/mol为单位列出。 图7.BT-ABA-5a前五个集群的群集直方图。使用AutoDock Tools用与LANCL2对接 的BT-ABA-5a执行一百次对接操作。RMSD集群容限是 结合能以kJ/mol为单位列出。 图8.羊毛硫氨酸合成酶C样蛋白质2(LANCL2)与BT-11和BT-15的结合动力学。图A 和C展示对变化浓度的BT-11(A)和BT-15(C)与固定化LANCL2的结合的表面等离子共振 (SPR)传感图。图B和D展示最大共振单位(RU)对比BT-11(B)和BT-15(D)浓度的曲线图。指示 利用1:1结合模型的稳态解离常数(KD)。 图9A和9B.羊毛硫氨酸合成酶C样蛋白质2(LANCL2)与BT-6(图9A)和BT-ABA-5a(图 9B)的结合动力学。展示对变化浓度的BT-6和BT-ABA-5a与固定化LANCL2的结合的表面等离 子共振(SPR)传感图。 图10.口服投药对患有葡聚糖硫酸钠(DSS)结肠炎的小鼠的疾病活动性和总病理 学的作用。图A展示在仅用BT-11或媒剂处理的小鼠中的疾病活动性指数评分。图B-C展示来 自在用媒剂或BT-11处理的小鼠中(B)脾脏、(C)肠系膜淋巴结(MLN)和(D)结肠的总病理学 评分。用星号指示统计学上显著的差异(P<0.05)(n=10)。 图11.口服BT-11投药对患有DSS结肠炎的小鼠中的结肠发炎性病变的作用。展示 (A,D)对照组(B,E)DSS和(C,F)经过BT-11处理的DSS小鼠的代表性显微图。基于(G)白细胞 浸润、(H)上皮细胞侵蚀和(I)粘膜增厚来评估组织病理学病变。用星号指示统计学上显著 11 CN 111592508 A 说 明 书 9/61 页 的差异(P<0.05)(n=10)。 图12.口服BT-11投药对患有DSS结肠炎的小鼠中的结肠发炎性病变的剂量反应作 用。基于(A)白细胞浸润、(B)粘膜增厚和(C)上皮细胞侵蚀来评估组织病理学病变。用星号 指示统计学上显著的差异(P<0.05)(n=10)。 图13.TNFα、白介素10(IL-10)和LANCL2的结肠基因表达分析。展示结肠基因表达 以评定(A)促炎性TNFα、(B)IL-10和(C)LANCL2的水平。用星号指示统计学上显著的差异(P< 0.05)(n=10)。 图14.经口投与BT-11对患有DSS结肠炎的小鼠中的结肠促炎性和抗炎性免疫细胞 子组的剂量反应作用。流式细胞测量术分析用于测量结肠粘膜中的(A)TNFa 细胞、(B)IL- 10 CD4 T细胞和(C)FOXP3 CD4 T细胞。 图15.口服BT-11投药对患有DSS结肠炎的野生型和LANCL2-/-小鼠中的组织总病 理学病变的作用。图A展示仅用BT-11或媒剂处理的野生型对比LANCL2-/-小鼠中的疾病活 动性指数评分。图B-D展示来自在用媒剂或BT-11处理的野生型和LANCL2-/-小鼠中的(B)结 肠、(C)肠系膜淋巴结(MLN)和(D)脾脏的总病理学评分。用星号指示统计学上显著的差异(P <0.05)(n=10)。 图16.口服BT-11投药对患有DSS结肠炎的野生型和LANCL2-/-小鼠中的结肠发炎 性病变的作用。基于(A)白细胞浸润、(B)粘膜增厚和(C)上皮细胞侵蚀来评估组织病理学病 变。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图17.口服BT-11投药对浸润患有慢性结肠炎的野生型和LANCL2-/-小鼠中结肠固 有层、脾脏和肠系膜淋巴结(MLN)的免疫细胞子组的作用。流式细胞测量术用于分析在用 BT-11处理之后的(A)结肠MCP1 CD45 细胞、(B)MLN中MCP1 CD45 细胞、(C)结肠TNFa CD45 细胞、(D)结肠MHC-II CD11c 粒细胞、(E)结肠IL-10 CD45 细胞和(F)IL-10 CD45 脾细胞 的水平。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图18.口服BT-11投药对患有慢性结肠炎的IL-10-/-小鼠中疾病活动性指数(DAI) 评分的作用。对发展出自发性结肠炎并且每日单独用媒剂或用每千克体重20、40和80mg BT-11处理的IL-10剔除式小鼠的DAI评分(n=10)。用星号指示群组之间的统计学上显著的 差异(P<0.05)。 图19.口服BT-11投药对在用BT-11处理之后的结肠炎慢性模型中宏观组织评分的 作用。在用媒剂或用三种不同浓度(20、40和80mg/Kg)的BT-11处理的小鼠的(A)脾脏、(B)肠 系膜淋巴结(MLN)和(C)结肠中的宏观评分。用星号指示群组之间的统计学上显著的差异(P <0.05)。 图20.口服BT-11投药对在IBD慢性IL-10-/-模型中结肠组织病理学病变的作用。 基于(A)白细胞浸润、(B)上皮细胞侵蚀和(C)粘膜增厚来评估组织病理学病变。用星号指示 群组之间的统计学上显著的差异(P<0.05)。 图21.口服BT-11投药对浸润患有慢性结肠炎的IL-10-/-中结肠固有层的免疫细 胞子组的作用。流式细胞测量术用于分析在用BT-11处理之后的结肠LP中(A)F4/80 巨噬细 胞、(B)MHC-II CD11c 树突状细胞(DC)、(C)CD4 FOXP3 调节性T细胞和(D)T辅助1(Th1)细 胞的水平。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图22.口服BT-11投药对浸润患有慢性结肠炎的IL-10-/-中脾脏和肠系膜淋巴结 12 CN 111592508 A 说 明 书 10/61 页 的免疫细胞子组的作用。流式细胞测量术用于分析在用BT-11处理之后的(A)CD4 RORgt T 细胞、(B)CD4 FOXP3 T细胞、(C)CD4 CD45 FOXP3 调节性T细胞和(D)T辅助1(Th1)细胞的水 平。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图23.用BT-11口服治疗对LANCL2和TNFα结肠表达的作用。结肠基因表达用于评定 (A)LANCL2和(B)TNFα的水平。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图24.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的小鼠中 疾病活动性指数评分的作用。在腹膜内转移400,000个未经处理的CD4 T细胞后,用媒剂或 BT-11处理RAG2-/-小鼠。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图25.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的野生型 对比LANCL2-/-转移小鼠中疾病活动性指数评分的作用。在由野生型或LANCL2-/-供体腹膜 内转移400,000个未经处理的CD4 T细胞后,用媒剂或BT-11处理RAG2-/-小鼠。用星号指示 群组之间的统计学上显著的差异(P<0.05)。 图26.口服BT-11投药对CD4 诱导结肠炎的慢性IBD模型中重量损失的作用。对小 鼠进行称重并计算重量损失百分比。用星号指示群组之间的统计学上显著的差异(P< 0.05)。 图27.口服BT-11投药对在用BT-11处理之后的CD4 T细胞诱导结肠炎慢性模型中 宏观组织评分的作用。展示在用媒剂或80mg/Kg BT-11处理的小鼠的(A)脾脏、(B)MLN、(C) 结肠和(D)回肠中的宏观评分。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图28.口服BT-11投药对在用BT-11处理之后的使用野生型和LANCL2-/-小鼠的CD4 T细胞诱导结肠炎慢性模型中宏观组织评分的作用。展示在用媒剂或80mg/Kg BT-11处理 的野生型和LANCL2-/-小鼠的(A)脾脏、(B)MLN和(C)结肠中的宏观评分。用星号指示群组之 间的统计学上显著的差异(P<0.05)。 图29.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的小鼠中 结肠和回肠组织病理学的作用。基于(A,B)白细胞浸润、(C,D)上皮细胞侵蚀和(E,F)粘膜增 厚来评估结肠(A,C,E)和回肠(B,D,F)中的组织病理学病变。用星号指示群组之间的统计学 上显著的差异(P<0.05)。 图30.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的用野生 型或LANCL2-/-CD4 T细胞转移的小鼠中结肠组织病理学的作用。基于(A)白细胞浸润、(B) 粘膜增厚和(C)上皮细胞侵蚀来评估组织病理学病变。用星号指示群组之间的统计学上显 著的差异(P<0.05)。 图31.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的小鼠中 疾病活动性指数评分的作用。流式细胞测量术用于分析在用BT-11处理之后的(A)F4/80 CD11b 巨噬细胞、(B)CD45 IFNg 细胞、(C)CD4 FOXP3 调节性T细胞和(D)CD4 IL-10 抗炎 性细胞的水平。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图32.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的小鼠中 疾病活动性指数评分的作用。流式细胞测量术用于分析在用BT-11处理之后的MLN中(A)CD4 FOXP3 T细胞、(B)CD4 IL-10 T细胞、(C)CD45 IFNg 细胞和脾脏中(D)CD4 FOXP3 T细胞、 (E)CD4 IL-10 T细胞、(F)CD45 IFNg 细胞的水平。用星号指示群组之间的统计学上显著的 差异(P<0.05)。 13 CN 111592508 A 说 明 书 11/61 页 图33.口服BT-11投药对慢性结肠炎过继转移模型中媒剂对比经过处理的野生型 对比PPARγ-/-转移小鼠中疾病活动性指数评分的作用。在由野生型或PPARγ-/-供体腹膜 内转移400,000个未经处理的CD4 T细胞后,用媒剂或BT-11处理RAG2-/-小鼠。(A)展示疾病 活动性指数评分对比转移后时间。基于(B)白细胞浸润、(C)粘膜增厚和(D)上皮细胞侵蚀来 评估结肠中的组织病理学病变。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图34.口服BT-11投药对患有糖尿病的NOD小鼠中空腹血液葡萄糖和胰岛素水平的 作用。(A)在用媒剂或BT-11(80mg/kg/d)处理第0、1、3、4、5、10和11周时评定空腹葡萄糖水 平。(B)在用媒剂或BT-11(80mg/kg/d)处理第5周时评定空腹血清胰岛素水平。用星号指示 统计学上显著的差异(P<0.05)(n=10)。 图35.口服BT-11投药在1型糖尿病小鼠胰脏中病变形成中的作用。基于白细胞浸 润、病变形成和组织侵蚀来评估组织病理学病变。用星号指示群组之间的统计学上显著的 差异(P<0.05)。 图36.口服BT-11投药对(A)空腹血液葡萄糖水平和(B)葡萄糖耐量测试的作用。 (A)在实验设置之后第2和12周,使小鼠禁食12h并且评定血液葡萄糖水平。(B)还用IP葡萄 糖注射(2g/Kg)攻击小鼠,并且测量葡萄糖。用星号指示统计学上显著的差异(P<0.05)。 图37.口服BT-11投药对促炎性群体向白色脂肪组织(WAT)中的浸润的作用。切除 WAT并加以消化,并且通过流式细胞测量术来评定免疫表型结果。展示(A)浸润性巨噬细胞 和(B)Ly6c高GR1 浸润性细胞的水平。用星号指示统计学上显著的差异(P<0.05)。 图38.口服BT-11投药对糖尿病db/db模型中葡萄糖稳态的作用。(A)展示在实验设 置之后第1和3周时,来自用BT-11或媒剂处理的瘦素受体缺陷型(db/db)小鼠的空腹血液葡 萄糖(FBG)浓度。(B)展示在腹膜内葡萄糖攻击(每千克体重1g)之后的血浆葡萄糖水平。在 葡萄糖负荷之前(0),接着在葡萄糖负荷之后15、30、60、90、120、180、220和265分钟时收集 血液。用星号指示群组之间的统计学上显著的差异(P<0.05)。 图39.口服BT-11投药对来自患有膳食诱导肥胖的小鼠的白色脂肪组织(WAT)中 LANCL2、TNFα和MCP-1表达的作用。与未处理的小鼠相比,评估LANCL2、TNFα和MCP-1的基因 表达分析。零处线表示仅接受媒剂的小鼠的基线。 图40.口服BT-11投药对感染有流感病毒的小鼠的临床评分和发病率的作用。小鼠 感染有流感病毒,并且在整个实验中进行临床评分。对(A)活动性和(B)身体外观标注临床 评分。(C)绘制损失超过15%体重的小鼠的百分比以展示发病率变化。用星号指示群组之间 的统计学上显著的差异(P<0.05)。












