技术摘要:
本发明涉及一种适配体核酸分子,包含该适配体和荧光团小分子的复合物,该适配体核酸分子用于检测细胞内或者细胞外的RNA、DNA或者其他靶分子的方法,以及包含该适配体的试剂盒。本发明的适配体可以特异性结合一种荧光团小分子,并显著提高其在合适波长光激发下的荧光强 全部
背景技术:
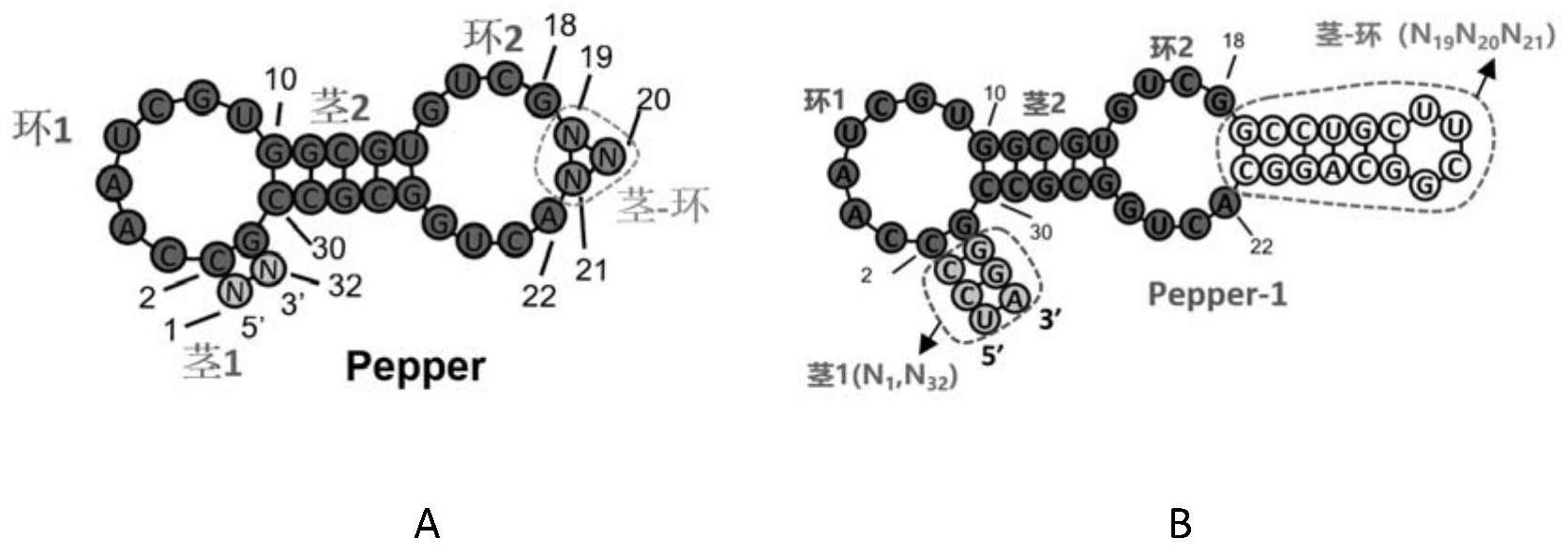
在所有的生物大分子中,RNA展示出了种类最为繁多的生物学功能。在生物的中心 法则中,RNA作为遗传物质的传递者(信使RNA)、蛋白质合成的模板(核糖体RNA)和氨基酸运 输工具(转移RNA),组成了一连串的生理过程,最终实现基因的转录与表达。过去的几十年 里,RNA在多种生命活动中发挥至关重要的功能被科学家们逐渐发掘出来,包括很多RNA-蛋 白质复合体,如端粒酶、剪接酶、核酶和核糖开关等。此外,近些年来一些非编码RNA,如短链 干扰RNA(siRNA)、小微RNA(microRNA)和长链非编码RNA(lncRNA)等,在转录后水平上对于 基因表达的调控发挥着不可替代的作用。实时监测细胞中RNA的运输和代谢过程对于研究 RNA的定位与基因表达以及细胞调控过程的关系是至关重要的。目前有科学家们已经鉴定 出了几种机理可以导致RNA的不同亚细胞定位,如主动运输、被动扩散,锚定等。在很多极性 细胞特别是神经细胞中,mRNA的空间特异性表达与神经元的可塑性、学习和记忆都密切相 关。因此,RNA的这些调控过程一旦被损坏就会引起神经元功能紊乱和神经系统疾病。 RNA荧光原位杂交技术是长期以来被广泛用于来研究RNA在细胞内水平与分布的 方法,它是通过分子杂交对特异RNA分子进行荧光标记,进而进行成像的技术。然而其操作 较复杂且含有洗脱步骤,只能用于固定化细胞亦即死细胞的研究,不能用于实时监测活细 胞中RNA的动态变化过程。分子信标技术是最早发展起来的活细胞RNA成像技术。它是利用 在5’和3’末端自身形成发夹结构的茎环双标记寡核苷酸探针,当其与靶标RNA结合后,标记 在一端的淬灭基团对荧光基团的淬灭作用消除,荧光基团产生荧光,或者两端荧光基团的 FRET消失。然而分子信标存在着荧光信号偏低、进细胞困难、易降解、较严重的细胞核内非 特异性聚集、易受RNA二级结构的影响且需要对每条RNA专门定制寡核苷酸探针等缺点,这 些缺点限制了该技术的广泛应用。 目前用于活细胞RNA成像的方法主要是利用MCP-FPs系统,MCP-FPs可以特异性识 别结合融合了多拷贝MS2序列的mRNA分子,通过检测荧光蛋白的信号实时监测mRNA的合成 及分布(Ozawa et al.Nature Methods 2007.4:413-419)。但由于未结合mRNA分子的MCP- FPs会产生很高的本底荧光,使得该方法的信噪比很低。随后,科学家们将MCP-FPs融合蛋白 加上核定位信号,使得没有与mRNA分子结合的GFP-MS2定位细胞核中,一定程度降低了细胞 浆中的非特异荧光,增加了检测的信噪比。 除了RNA结合蛋白-荧光蛋白技术检测细胞RNA外,科学家们一直在寻找一个类似 GFP的RNA荧光标签用于RNA成像。科学家们构建了一个荧光团-淬灭剂结合体,当荧光团的 适配体(Aptamer)与荧光团结合时,淬灭剂就不能将荧光团的荧光信号淬灭,此时适配体- 荧光团-淬灭剂构成的复合物是有荧光的。当荧光团的适配体不存在时,荧光团的荧光信号 7 CN 111593052 A 说 明 书 2/39 页 就会被淬灭剂淬灭。基于这样的原理,科学家们实现了对细菌中mRNA的成像(Arora et al .Nucleic Acids Research 2015 .21:e144)。此外,人们还开发了一个称为IMAGE (intracellular multi aptamer genetic)的标签,它由两种不同的适配体-小分子复合物 构成。当小分子结合到RNA序列中的适配体上时,相邻的两个小分子所携带的荧光团就会发 生荧光共振能量转移(FRET)现象,通过检测荧光信号的变化就可以检测细胞中RNA情况。然 而这两种方法目前均没有在哺乳动物细胞中实现对RNA的实时监测。2011年S.Jaffrey课题 组获得了一个称为“Spinach”的核酸适配体,它可以特异性结合一个荧光团(3 ,5- difluoro-4-hydroxybenzyli-dene imidazolinone,DFHBI),使得其荧光得到显著增加 (Paige et al.Science 2011 .333:642-646;Strack et al.Nature Methods 2013.10: 1219-1224)。“Spinach”的突变体“Spinach2”有着更好的稳定稳定性,它提供了一个很好的 工具用于遗传编码标记活细胞中的RNA。该课题组将”Spinach”中的一个茎环结构换成可以 特异性结合细胞代谢物的核酸适配体,开发了基于Spinach-DFHBI复合物的可以检测细胞 代谢物的工具(Paige et al.Science 2012.335:1194)。到目前为止,该方法已被成功用于 分监测和分析细菌、酵母和哺乳动物细胞中的RNA动态变化。随后,该课题组还开发了Corn- DFHO复合物用于检测哺乳动物细胞RNA聚合酶III启动子的活性检测(Song et al.Nature Chemical Biology 2017.13:1187-1194)。然而,该方法还存在以下缺点大大限制了它的广 泛应用:(1)适配体-荧光团复合物的结合能力较弱,其解离常数(kd)为几十到几百nM;(2) 适配体-荧光团形成的复合物的荧光信号不稳定,极容易发生淬灭,使得其荧光信号不宜被 检测(Han et al .Journal of the American Chemical Society 2013 .135:19033- 19038);(3)目前为止,光谱只有绿色和黄色,缺乏更长波长的光谱对活体动物体内的RNA进 行成像(Song et al .Journal of the American Chemical Society 2014 .136:1198- 1201);(4)Corn为二聚体,可能会干扰靶标RNA的功能;(5)目前还没有其他的适配体-荧光 团复合物,不能同时监测细胞中的多条RNA。 综上所述,目前使用的RNA标记技术都存在各自的明显的缺点。MCP-FPs标记技术 存在着非结合的本底荧光强,信噪比低。基于适配体-荧光团-淬灭剂构成的复合物的RNA标 记技术目前只在细菌中实现对RNA的标记,还没有实现在哺乳动物细胞中标记RNA。基于单 荧光团-核酸适配体的RNA标记技术看起来是非常完美的RNA标记技术,然而受限于当前的 荧光团(DFHBI,DFHBI-1T,DFHO)与核酸适配体形成的复合体的性质不理想,该技术也没有 被广泛使用。因此,科研界和产业界一直都需要更加有效的荧光团-核酸适配体复合物,能 克服此前荧光团-核酸适配体复合物的缺点,用于活细胞中的RNA或DNA的实时标记。 发明的简述 本发明提供了一种核酸适配体分子,编码该核酸适配体分子的DNA分子,一种核酸 适配体分子与荧光团分子的复合物,以及该复合物的用途。 本发明提供的技术方案如下: 1 .本发明涉及一种核酸适配体分子,所述适配体分子包含下述核苷酸序列(a)、 (b)或(c): (a)核苷酸序列N1CCAAUCGUGGCGUGUCGN19-N20-N21ACUGGCGCCGN32(称为通式Pepper 结构),其中N1、N19、N20、N21和N32代表长度≧1个的核苷酸片段,并且N1与N32核苷酸序列中至 少有一对碱基形成互补配对,N19与N21核苷酸序列中至少有一对碱基形成互补配对; 8 CN 111593052 A 说 明 书 3/39 页 (b)与(a)限定的核苷酸序列具有至少70%同一性的核苷酸序列; (c)在(a)限定的核苷酸序列中不包括N1、N19、N20、N21和N32的位置,经过一个或几个 核苷酸的取代、缺失和/或添加,且具有适配体功能的由(a)衍生的核酸适配体分子。 2.根据(1)所述的核酸适配体分子,其中与(a)所述的Pepper结构核苷酸序列具有 至少75%,76%,78%,80%,82%,85%,87%,90%,93%,95%,96%,97%,98%,99%或 100%同一性的序列。 3.根据(1)所述的核酸适配体分子,其中核苷酸序列(c)是在(a)限定的Pepper结 构核苷酸序列中不包括N1、N19、N20、N21和N32的位置,经过10个、9个、8个、7个、6个、5个、4个、3 个、2个或1个核苷酸的取代、缺失和/或添加而得到的核酸适配体分子。 4.根据(3)所述的核酸适配体分子,其中核苷酸序列(c)是在(a)限定的核苷酸序 列中不包括N1、N19、N20、N21和N32的位置,经过7个、6个、5个、4个、3个、2个或1个核苷酸的取代 而得到的核酸适配体分子。 5.根据(1)所述的核酸适配体分子,其中核苷酸序列(a)中的N1与N32互补配对时, N1核苷酸序列的方向为5’-3’,N32核苷酸序列的方向为3’-5’;N19与N21互补配对时,N19核苷 酸序列的方向为5’-3’,N21核苷酸序列的方向为3’-5’。 6.根据(5)所述的核酸适配体分子,其中当N1与N32中的至少一条片段的长度≥5个 核苷酸碱基时,则N1与N32核苷酸序列中至少有两对碱基形成互补配对;当N19与N21中的至少 一条片段的长度≥5个核苷酸碱基时,则N19与N21核苷酸序列中至少有两对碱基形成互补配 对。 7.根据(1)-(6)任一项所述的核酸适配体分子,其中对通式Pepper结构的核苷酸 取代选自下组中的一种:C3A、C3U、A4U、A4G、A4C、A5G、A5C、U6A、U6G、U6C、C7A、C7U、G8C、U9A、 G11A、G11U、C12G、C12A、C12U、G13C、U14A、U14G、C17U、G18U、G18C、C27G、C27U、G28U、C29G、 C29U、C30A、C30U、C2G/G31C、C2U/G31A、C2A/G31U、G10A/C30U、G10C/C30G、G10U/C30A、C2G/ G31C/C3A、C2G/G31C/A4C、C2G/G31C/A5C、C2G/G31C/G8C、C2G/G31C/C12U、C2G/G31C/U14G、 C2G/G31C/C27U、C2G/G31C/C29G、C2G/G31C/C30U、C2G/G31C/G10A/C30U、C2G/G31C/G10C/ C30G、C2G/G31C/G10U/C30A、C2U/G31A/G10A/C30U、C2U/G31A/G10C/C30G、C2U/G31A/G10U/ C30A、C2A/G31U/G10A/C30U、C2A/G31U/G10C/C30G、C2A/G31U/G10U/C30A、C2G/G31C/G10C/ C30G/C3A、C2G/G31C/G10C/C30G/A4C、C2G/G31C/G10C/C30G/A5C、C2G/G31C/G10C/C30G/ G8C、C2G/G31C/G10C/C30G/C12U、C2G/G31C/G10C/C30G/U14G、C2G/G31C/G10C/C30G/C27U、 C2G/G31C/G10C/C30G/C29G、C2G/G31C/G10A/C30U/U6G/C27U、C2G/G31C/G10C/C30G/U6G/ C27U、C2G/G31C/G10U/C30A/U9A/U14G/C27U和C2A/G31U/G10U/C30A/U9A/U14G/C27U。 8.根据(7)所述的核酸适配体分子,其中对通式Pepper结构的核苷酸取代选自下 组中的一种:C3A、C3U、A4C、A5C、C7U、G8C、U9A、C12G、C12U、U14G、C27U、C29G、C30U、C2G/ G31C、C2U/G31A、C2A/G31U、G10A/C30U、G10C/C30G、G10U/C30A、C2G/G31C/C3A、C2G/G31C/ A4C、C2G/G31C/A5C、C2G/G31C/G8C、C2G/G31C/C12U、C2G/G31C/U14G、C2G/G31C/C27U、C2G/ G31C/C29G、C2G/G31C/C30U、C2G/G31C/G10A/C30U、C2G/G31C/G10C/C30G、C2G/G31C/G10U/ C30A、C2U/G31A/G10A/C30U、C2U/G31A/G10C/C30G、C2U/G31A/G10U/C30A、C2A/G31U/G10A/ C30U、C2A/G31U/G10C/C30G、C2A/G31U/G10U/C30A、C2G/G31C/G10C/C30G/C3A、C2G/G31C/ G10C/C30G/A4C、C2G/G31C/G10C/C30G/A5C、C2G/G31C/G10C/C30G/G8C、C2G/G31C/G10C/ 9 CN 111593052 A 说 明 书 4/39 页 C30G/C12U、C2G/G31C/G10C/C30G/U14G、C2G/G31C/G10C/C30G/C27U、C2G/G31C/G10C/C30G/ C29G、C2G/G31C/G10A/C30U/U6G/C27U和C2G/G31C/G10C/C30G/U6G/C27U。 9.根据(8)所述的核酸适配体分子,其中对通式Pepper结构的核苷酸取代选自下 组中的一种:C3A、C3U、A4C、A5C、C7U、G8C、U9A、C12G、C12U、U14G、C27U、C29G、C30U、C2G/ G31C、C2U/G31A、C2A/G31U、G10A/C30U、G10C/C30G、G10U/C30A、C2G/G31C/C3A、C2G/G31C/ A4C、C2G/G31C/A5C、C2G/G31C/G8C、C2G/G31C/C12U、C2G/G31C/U14G、C2G/G31C/C27U、C2G/ G31C/C29G、C2G/G31C/C30U、C2G/G31C/G10A/C30U、C2G/G31C/G10C/C30G、C2G/G31C/G10U/ C30A、C2U/G31A/G10A/C30U、C2U/G31A/G10C/C30G、C2U/G31A/G10U/C30A、C2A/G31U/G10A/ C30U、C2A/G31U/G10C/C30G和C2A/G31U/G10U/C30A。 10.根据(1)-(9)所述的核酸适配体分子,其中核苷酸序列(a)中的N1与N32处的核 苷酸序列为F30或tRNA脚手架RNA序列。 11.根据前述任一项所述的核酸适配体分子,其中的适配体分子是RNA分子或经碱 基修饰的RNA分子。 12.根据前述任一项所述的核酸适配体分子,其中的适配体分子是DNA-RNA杂交分 子或经碱基修饰的DNA-RNA分子。 13.根据前述任一项所述的核酸适配体分子,其中的N19-N20-N21包含一个可以识别 靶标分子的核苷酸序列。 14.根据(13)所述的核酸适配体分子,其中的靶标分子包括但不限于:蛋白质,核 酸,脂质分子,碳水化合物,激素,细胞因子,趋化因子,代谢物金属离子。 15.根据(13)或(14)所述的核酸适配体分子,其中的N19-N20-N21为可以识别GTP和 腺苷分子的核苷酸序列。 16.根据前述任一项所述的核酸适配体分子,所述的适配体功能是指核酸适配体 能提高荧光团分子在合适波长激发光下的荧光强度至少2倍,至少5-10倍,至少20-50倍,至 少100-200倍或者提高至少500-1000倍。 17.据(1)所述的核酸适配体分子,其中还可包含可以结合多个荧光团分串联体, 所述串联体通过适当长度的间隔序列连在一起,个数可以是2、3、4、5、6、7、8或者更多。所述 串联体的核苷酸可选自但不限于序列SEQ ID No:8、9、10,11、12、13、14、15、16、17、18和19。 18 .根据任一项所述的核酸适配体分子,其中的核酸适配体分子具有序列SEQ IDNo:1、2、3、6、7、8、9、10、11、12、13、14、15、16、17、18、19、21、22或23。 19.一种核酸适配体分子与荧光团分子的复合物,其中所述的核酸适配体分子为 (1)-(17)任一项所述核酸适配体分子,所述的荧光团分子具有下述式(I)所述的结构: 其中:D-为X1O-或N(X2)(X3)-;X1、X2、X3各自独立地选自氢、1-10个碳的直链或支 链烷基和改性烷基,X2、X3任选相互连接为饱和或不饱和的环;R-选自氢、氰基、羧基、酰胺 基、酯基、羟基、1-10个碳的直链或支链烷基或改性烷基;Ar1、Ar2各自独立地选自单环芳亚 基、单环杂芳亚基,或由单环芳基、单环杂芳基中的一种或两种稠合组成的具有2-3个环结 10 CN 111593052 A 说 明 书 5/39 页 构的芳香亚基; 其中:Ar1、Ar2中的氢原子可以独立地被F、Cl、Br、I、羟基、硝基、醛基、羧基、氰基、 磺酸基、硫酸基、磷酸基、氨基、伯氨基、仲氨基、1-10个碳的直链或支链烷基和改性烷基取 代; 其中:以上所述改性烷基为烷基的任意碳原子被选自F、Cl、Br、I、-O-、-OH、-CO-、- NO2、-CN、-S-、-SO2-、-(S=O)-、叠氮基、亚苯基、伯氨基、仲氨基、叔氨基、季铵盐基、环氧乙 烷、琥珀酸酯、异氰酸酯、异硫氰酸酯、酰氯、磺酰氯、饱和或不饱和的单环或双环亚环羟基、 桥联酯杂环中的至少一种基团置换所得的基团,所述改性烷基具有1-10个碳原子,其中碳 碳单键任选独立地被碳碳双键或碳碳三键置换; 其中,复合物中的核酸适配体分子与荧光团分子分别存在于单独的溶液中,或者 核酸适配体分子与荧光团分子在同一溶液中。 20.如19所述的荧光团分子的复合物,所述改性烷基含有选自-OH、-O-、乙二醇单 元、单糖单元、二糖单元、-O-CO-、-NH-CO-、-SO2-O-、-SO-、Me2N-、Et2N-、-S-S-、-CH=CH-、F、 Cl、Br、I、-NO2和氰基中的至少一种基团; 可选地,荧光团分子含有的芳香环选自下式(Ⅱ-1)~(Ⅱ-15)中的结构: 可选地,荧光团分子选自下式化合物: 11 CN 111593052 A 说 明 书 6/39 页 21.根据(20)所述的复合物,其中的荧光团分子选自III-1、III-2、III-3、III-4、 III-5、III-6、III-7、III-8、III-9、III-10、III-11、III-12、III-13、III-14、III-15、III- 16、III-17、III-18、III-19、III-20和III-21。 22.根据(19)-(21)任一项所述的复合物,其中复合物中的适配体分子包含核苷酸 序列SEQ ID No:1、2、3、6、7、8、9、10、11、12、13、14、15、16、17、18、19、21、22、23、24、25、26、 27、28、29、30或31。 23.一种(19)-(22)任一项所述的复合物用于体外或体内目标核酸分子的检测或 标记。 24.一种(19)-(22)任一项所述的复合物用于细胞外或细胞内靶标分子的检测或 标记。 25.一种(19)-(22)任一项所述的复合物用于对基因组DNA进行成像。 26.一种(19)-(22)任一项所述的复合物用于检测细胞中mRNA与蛋白质含量的关 系。 27.一种DNA分子,其转录(1)-(18)任一项所述的核酸适配体分子。 28.一种表达载体,其包含(27)所述的DNA分子。 29.一种宿主细胞,其包含(28)所述的表达系统。 30.一种试剂盒,包含技术方案1-18任一项所述的核酸适配体分子和/或技术方案 28所述的表达载体和/或技术方案29所述的宿主细胞和/或技术方案19-22任一项所述的复 合物。 31.一种检测靶标分子的方法,包括步骤: a)在包含靶标分子的溶液中加入技术方案(19)-(22)任一项任一项所述的复合 物; b)用合适波长的光激发复合物; c)检测复合物的荧光。 12 CN 111593052 A 说 明 书 7/39 页 32.一种检测基因组DNA的方法,包含技术方案(19)-(22)任一项所述复合物对基 因组DNA进行成像。 33.一种提取与纯化RNA的方法,包含利用技术方案(19)-(22)任一项所述复合物 提取与纯化RNA。 本发明人设计了全新的核酸适配体分子,并合成全新的荧光团分子,组成全新的 荧光团-核酸适配体复合物,适配体分子结合荧光团分子之后可以显著提高荧光团分子在 合适波长激发光下的荧光强度,它们克服了此前荧光团-核酸适配体复合物的缺点,能有效 用于活细胞中的RNA/DNA实时标记。本发明的核酸适配体对荧光团分子具有很强的亲和力, 并展现出了不同的荧光光谱和很好的光与温度稳定性。这些核酸适配体-荧光团分子复合 物可以对原核和真核细胞中RNA/DNA进行实时标记与成像,检测蛋白质-RNA相互作用,探究 细胞中mRNA含量与蛋白质间关系,或用于RNA的提取与纯化的标签等作用。 附图说明 图1.核酸适配体分子的二级结构预测。(A)为预测的Pepper的通用结构,包括可以 形成茎结构的N1和N32,可以形成茎环结构的N19、N20和N21。(B)为预测的Pepper-1的结构,N1 和N32的碱基序列如图中茎1所对应的虚线框所示,N19、N20和N21的碱基序列如茎环所对应的 虚线框所示。 图2.F30-Pepper-1的二级结构预测。 图3.tRNA-Pepper-2的二级结构预测。 图4.F30-Pepper-1-III-3复合物性质鉴定。(A)F30-Pepper-1-III-3复合物的荧 光激发光谱和发射光谱;(B)F30-Pepper-1-III-3复合物和III-3的吸收光谱;(C)F30- Pepper-1-III-3复合物的寡聚化鉴定;“标尺”为单链DNA标准,用于标定适配体的大小。(D) F30-Pepper-1与III-3结合的解离常数测定;(E)F30-Pepper-1-III-3复合物温度稳定性测 定;(F)F30-Pepper-1-III-3复合物的pH稳定性测定;(G)F30-Pepper-1-III-3复合物对K 的依赖性测定。 图5.不同碱基修饰的Pepper对III-3的激活效果。(A)含脱氧核糖核苷酸(图中深 色颜色标注)的Pepper-3适配体的二级结构示意图;(B)含2’F修饰(图中深色颜色标注)的 Pepper-4适配体的二级结构示意图;(C)含不同修饰的Pepper对III-3的激活效果。“对照” 是利用缓冲液替换Pepper-3或Pepper-4适配体。 图6.不同Pepper串联体对III-3的激活效果。(A)按照“串联1”方式获得Pepper串 联体;(B)按照“串联2”方式获得Pepper串联体;(C)按照“串联3”方式获得Pepper串联体; (D)不同按照“串联1”方式获得Pepper串联体对III-3的激活效果;(E)不同按照“串联2”方 式获得Pepper串联体对III-3的激活效果;(F)不同按照“串联3”方式获得Pepper串联体对 III-3的激活效果。 图7.F30-Pepper-1-III-3复合物用于细菌中RNA的标记效果; 图8.F30-Pepper-1-III-3复合物用于酵母细胞中RNA的标记效果; 图9.Pepper与III-3及其类似物用于哺乳动物细胞中RNA的标记的标记效果。(A) 比较F30-Pepper-1-III-3、F30-Broccoli-DFHBI-1T和tRNA-Corn-DFHO在哺乳动物细胞中 标记RNA的效果;(B)对(A)图荧光的统计结果;(C)F30-8Pepper-5与III-3类似物在哺乳动 13 CN 111593052 A 说 明 书 8/39 页 物细胞中标记RNA的效果。 图10.基于Pepper-1的探针构建。(A)探针构建示意图,其中的茎-环结构能识别腺 苷或者能识别GTP;(B)腺苷探针的检测效果;(C)GTP探针的检测效果。 图11.Pepper用于示踪细胞中RNA定位。(A)Pepper用于检测GAPDH mRNA的定位; (B)Pepper用于检测TMED2mRNA的定位。 图12.Pepper用于探究细胞中mRNA与蛋白质间的关系。(A)BFP蛋白质与其RNA表达 的流式细胞仪分析结果;(B)mCherry蛋白质与其RNA表达的流式细胞仪分析结果。 图13.Pepper用于检测基因组DNA。(A)dCas9和不同嵌合sgRNA示意图;(B)dCas9和 不同嵌合sgRNA对基因组DNA成像结果;(C)对(B)中每个细胞中的亮点颗粒进行统计结果。 图14.Pepper用于RNA的超分辨成像。(A)4Pepper-9-MS2 RNA与tdMCP-BFP-H2B蛋 白的共定位情况;(B)细胞核中层的宽场和SIM成像结果;(C)细胞核顶层的宽场和SIM成像 结果; 图15.Pepper用于RNA的提取与纯化的标签。“标尺”为单链DNA标准,用于标定适配 体的大小。 发明详述 本发明在此通过对使用下述定义和实施例的引用进行详细描述。所有在本文中提 及的专利和公开文献的内容,包括在这些专利和公开中披露的所有序列,明确地通过提述 并入本文。下文中,“核苷酸”与“核苷酸碱基”互换使用,表示相同意思。 核酸适配体分子 本发明所述的“核酸适配体分子”也称为“适配体分子”。该核酸适配体分子包含 (a)核苷酸序列为N1CCAAUCGUGGCGUGUCGN19-N20-N21ACUGGCGCCGN32(对应于图1A的通式 Pepper结构);或(b)与(a)所述的核苷酸序列具有至少70%同一性的序列;其中N1与N32核苷 酸序列中至少有一对碱基形成反向互补配对,即N1核苷酸序列的方向为5’-3’,N32核苷酸序 列的方向为3’-5’。当N1与N32至少一条核苷酸碱基长度≤4时,需要至少一对碱基形成互补 配对;当N1与N32至少一条核苷酸碱基长度≥5时,需要至少两对碱基形成互补配对。其中N19 与N21核苷酸序列中至少有一对碱基形成反向互补配对,即N19核苷酸序列的方向为5’-3’, N21核苷酸序列的方向为3’-5’。当N19与N21至少一条核苷酸碱基长度≤4时,需要至少一对碱 基形成互补配对;当N19与N21至少一条核苷酸碱基长度≥5时,需要至少两对碱基形成互补 配对。其中N20为任意长度任意组成的核苷酸碱基;或(c)在所述的核苷酸序列(a)的任一位 置经过1-7个核苷酸的取代、缺失和/或增加。 核酸适配体分子包含对通式Pepper结构的核苷酸的取代,该取代选自下组中的一 种:C3A、C3U、A4U、A4G、A4C、A5G、A5C、U6A、U6G、U6C、C7A、C7U、G8C、U9A、G11A、G11U、C12G、 C12A、C12U、G13C、U14A、U14G、C17U、G18U、G18C、C27G、C27U、G28U、C29G、C29U、C30A、C30U、 C2G/G31C、C2U/G31A、C2A/G31U、G10A/C30U、G10C/C30G、G10U/C30A、C2G/G31C/C3A、C2G/ G31C/A4C、C2G/G31C/A5C、C2G/G31C/G8C、C2G/G31C/C12U、C2G/G31C/U14G、C2G/G31C/C27U、 C2G/G31C/C29G、C2G/G31C/C30U、C2G/G31C/G10A/C30U、C2G/G31C/G10C/C30G、C2G/G31C/ G10U/C30A、C2U/G31A/G10A/C30U、C2U/G31A/G10C/C30G、C2U/G31A/G10U/C30A、C2A/G31U/ G10A/C30U、C2A/G31U/G10C/C30G、C2A/G31U/G10U/C30A、C2G/G31C/G10C/C30G/C3A、C2G/ G31C/G10C/C30G/A4C、C2G/G31C/G10C/C30G/A5C、C2G/G31C/G10C/C30G/G8C、C2G/G31C/ 14 CN 111593052 A 说 明 书 9/39 页 G10C/C30G/C12U、C2G/G31C/G10C/C30G/U14G、C2G/G31C/G10C/C30G/C27U、C2G/G31C/G10C/ C30G/C29G、C2G/G31C/G10A/C30U/U6G/C27U、C2G/G31C/G10C/C30G/U6G/C27U、C2G/G31C/ G10U/C30A/U9A/U14G/C27U和C2A/G31U/G10U/C30A/U9A/U14G/C27U(即表1中的适配体分子 结构)。这些突变体能特异性结合荧光团分子,并在结合之后可以显著提高荧光团分子在合 适波长激发光下的荧光强度。其中核苷酸的位置序列对应于图1A中的位置。 上述的突变表示在通式Pepper结构的适配体核苷酸序列的相应位点发生核苷酸 替换,如C3A表示Pepper的第3位胞嘧啶核苷酸C被取代为腺嘌呤核苷酸A,也即表1中的 Pepper(C3A);C2G/G31C表示Pepper的第2位C被取代为G,同时第31位G被取代为C,也即表1 中的Pepper(C2G/G31C)。 表1:Pepper通式结构经过7个、6个、5个、4个、3个、2个或1个核苷酸取代的适配体 结构 15 CN 111593052 A 说 明 书 10/39 页 16 CN 111593052 A 说 明 书 11/39 页 适配体分子是单链核酸分子,它们有着一个或多个碱基配对区域(茎)以及一个或 多个非配对的区域(环)构成的二级结构(图1)。本发明所述的核酸适配体分子包含一个如 图1所预测的二级结构。该二级结构含有2个环结构、2个茎结构和一个茎-环结构,其中茎1 是起到稳定整个核酸适配体分子结构的作用,可以被替换成其他可以形成茎结构的任意长 度任意组成的核苷酸碱基对。所述茎1结构的5’端或3’端可以与任意目标RNA分子融合,用 于细胞外或细胞内检测目标RNA分子。在本发明一优选的实施方案中,核酸适配体分子的5’ 端融合5S RNA序列(Genebank:NR_023377.1);在本发明另一优选的实施方案中,核酸适配 体分子的5’端融合GAPDH RNA序列(Genebank:BC009081)。 图1中的茎-环结构起到稳定整个核酸适配体分子结构的作用,可以被替换成其他 可以形成茎-环结构的任意长度任意组成的核苷酸碱基对。本发明所述的适配体分子还可 包含插入到N19-N20-N21位置的其他核苷酸序列,该插入的核苷酸序列替换图1A中的茎-环结 构。所述核苷酸序列可以特异性识别/结合靶标分子。当靶标分子不存在时,所述适配体分 子与荧光团分子的结合能力弱,导致荧光团分子显示弱荧光;当靶标分子存在时,靶标分子 与所述适配体的结合会促进所述适配体与荧光团分子的结合,显著提高荧光团分子在合适 波长激发光下的荧光。所述靶标分子可以是一种小分子、一种细胞表面的信号分子等。这些 核酸适配体与特定的靶标分子通过非共价结合,这种非共价结合主要是依赖分子间的离子 力、偶极力、氢键、范德华力、正负电子相互作用、堆积作用或者以上几种作用力的结合。所 述茎-环结构可被替换成识别靶标分子的RNA序列,用于细胞外或细胞内检测靶标分子。在 本发明一优选的实施方案中,适配体分子的茎-环结构可以结合GTP分子;在本发明另一优 选的实施方案中,茎-环结构可以结合腺苷分子。 本发明优选的实施方案中,所述核酸适配体分子优选为SEQ ID NO:1,2,3,6,7,8, 9,10,11,12,13,14,15,16,17,18,19,21,22或23,或者可以结合荧光团分子显著提高其在 17 CN 111593052 A 说 明 书 12/39 页 合适波长激发光下荧光的它们的突变序列。 本发明所述的核酸适配体分子还可包含一段增加其稳定性的核苷酸序列。在本发 明的一优选的实施方案中,采用F30脚手架RNA(序列2),其与所述核酸适配体分子的连接方 式如图2所示;在在本发明的另一优选的实施方案中,采用tRNA脚手架RNA(序列3),其与所 述核酸适配体分子的连接方式如图3所示。 本发明中所述的“核酸适配体分子”是一种RNA分子,或者部分核苷酸被替换成脱 氧核糖核苷酸的DNA-RNA杂交分子。其中的核苷酸可以是它们的D和L对映体形式,同时也包 含它们的衍生物,包括但不限于2’-F,2’-氨基,2’-甲氧基,5’-iodo,5’-溴-修饰的多聚核 苷酸。核酸包含各种修饰的核苷酸。 同一性 “同一性”在本发明中描述两个核苷酸序列之间的相关性。本发明的两个适配体核 苷酸序列的同一性计算中不包括(a)序列中的N1、N19、N20、N21、N32。就本发明而言,两个核苷 酸序列之间的同一性程度使用如EMBOSS软件包(EMBOSS:The European Molecular Biology Open Software Suite,Rice等,2000,Trends in Genetics16:276-277)的Needle 程序,优选3.0 .0版或更高版本中执行的Needleman-Wunsch算法(Needleman和Wunsch, 1970,J.Mol.Biol.48:443-453)来确定。使用的任选参数为缺口罚分(gap penalty)10,缺 口延伸罚分(gap extension penalty)0.5和EBLOSUM62取代矩阵(BLOSUM62的EMBOSS版)。 使用Needle标记为“最高同一性(longest identity)”(使用-nobrief选项获得)的输出结 果作为百分比同一性,并计算如下: (相同的残基×100)/(比对长度-比对中缺口的总数)。 如本发明表1中Pepper(C3A)和Pepper(C3U)的序列为N1CAAAUCGUGGCGUGUCGN19- N20-N21ACUGGCGCCGN32和N1CUAAUCGUGGCGUGUCGN19-N20-N21ACUGGCGCCGN32,对它们同一性比对 的时候,按照本发明的定义,应不包含N1、N19-N20-N21和N32的核苷酸碱基,因此它们的序列同 一性比对结果为96.3%(相差1个核苷酸)。 荧光团分子 本发明所述的“荧光团分子”也称为“荧光团”或“荧光分子”。“荧光团分子”在本发 明中是一类可被条件性激活的荧光团分子。它们在没有核酸适配体的情况下显示出较低的 量子产率。在具体的实施方式中,当没有与特定适配体结合时,荧光团的量子产率低于0.1, 更优的低于0.01,最优的低于0.001;当荧光团被特定适配体结合后,荧光团的量子产率提 高2倍以上,更优的提高10倍以上,最优的提高100倍以上。荧光团分子优选水溶性的,对细 胞无毒且易穿透膜的。本发明的荧光团优选能够通过主动运输或者被动扩散通过细胞膜或 细胞壁进入细胞浆或细胞周质。在本发明的实施方式中,荧光团可以透过革兰氏阴性菌的 外膜和内膜,植物细胞的细胞壁和细胞膜,真菌和细胞壁和细胞膜,动物细胞的细胞膜,以 及活体动物的GI和内皮细胞膜。 本发明所述的核酸适配体分子可以特异性结合一种荧光团,显著增加其在特定波 长激发下的荧光值。所述荧光团分子选自结构(Ⅰ): 18 CN 111593052 A 说 明 书 13/39 页 (Ι)其中:D-为X1O-或N(X2)(X3)-,X1、X2、X3各自独立地选自氢、1-10个碳的直链或 支链烷基和改性烷基,X2、X3任选相互连接为饱和或不饱和的环;R-选自氢、氰基、羧基、酰胺 基、酯基、羟基、1-10个碳的直链或支链烷基或改性烷基;Ar1、Ar2各自独立地选自单环芳亚 基、单环杂芳亚基,或由单环芳基、单环杂芳基中的一种或两种稠合组成的具有2-3个环结 构的芳香亚基; 其中:Ar1、Ar2中的氢原子可以独立地被F、Cl、Br、I、羟基、硝基、醛基、羧基、氰基、 磺酸基、硫酸基、磷酸基、氨基、伯氨基、仲氨基、1-10个碳的直链或支链烷基和改性烷基取 代; 其中:以上所述改性烷基为烷基的任意碳原子被选自F、Cl、Br、I、-O-、-OH、-CO-、- NO2、-CN、-S-、-SO2-、-(S=O)-、叠氮基、亚苯基、伯氨基、仲氨基、叔氨基、季铵盐基、环氧乙 烷、琥珀酸酯、异氰酸酯、异硫氰酸酯、酰氯、磺酰氯、饱和或不饱和的单环或双环亚环羟基、 桥联酯杂环中的至少一种基团置换所得的基团,所述改性烷基具有1-10个碳原子,其中碳 碳单键任选独立地被碳碳双键或碳碳三键置换; 可选地,上述荧光团分子含有的改性烷基为含有选自-OH、-O-、乙二醇单元、单糖 单元、二糖单元、-O-CO-、-NH-CO-、-SO2-O-、-SO-、Me2N-、Et2N-、-S-S-、-CH=CH-、F、Cl、Br、 I、-NO2、氰基中的至少一种基团; 可选地,上述荧光团分子含有的芳香环选自下式(Ⅱ-1)~(Ⅱ-15)中的结构: 可选地,上述荧光团分子选自下式化合物: 19 CN 111593052 A 说 明 书 14/39 页 本发明优选的实施方案中,所述荧光团分子包含III-1、III-2、III-3、III-4、III- 5、III-6、III-7、III-8、III-9、III-10、III-11、III-12、III-13、III-14、III-15、III-16、 III-17、III-18、III-19、III-20和III-21。“提高荧光信号”、“荧光增加”、“提高荧光强度”、 “增加荧光强度”在本发明中指合适波长激发光照射下荧光团量子产率的提高,或者荧光信 号最大发射峰的迁移(相对乙醇或者水溶液中荧光团本身的发射峰),或者摩尔消光系数的 增加,或者以上的两种或更多。在本发明一优选实施方式中,量子产率的增加至少是2倍;在 本发明另一优选实施方式中,量子产率的增加至少是5-10倍;在本发明另一更优选实施方 式中,量子产率的增加至少是20-50倍;在本发明另一更优选实施方式中,量子产率的增加 至少是100-200倍;在本发明另一更优选实施方式中,量子产率的增加至少是500-1000倍; 在本发明另一更优选实施方式中,量子产率的增加至少是1000-10000倍;在本发明另一更 优选实施方式中,量子产率的增加大于10000倍;用于激发荧光团产生荧光信号的光源可以 是任意合适的光照设备,如包括LED灯、白炽灯、荧光灯、激光;激发光既可以是直接从这些 设备中发出,也可以间接通过其他荧光团获取,如FERT的供体荧光团,或BRET的供体发光 20 CN 111593052 A 说 明 书 15/39 页 团。 靶标分子 本发明所述的靶标分子可以是任意的生物材料或者小分子,包括但不限于:蛋白 质,核酸(RNA或者DNA),脂质分子,碳水化合物,激素,细胞因子,趋化因子,代谢物金属离子 等。靶标分子可以是与疾病或者病原菌感染相关的分子。 通过在本发明所述的适配体分子,如图1所示的结构中,该插入的核苷酸序列替换 了图1中的N19、N20、N21的茎-环结构,该核苷酸序列可以特异性识别/结合靶标分子。当靶标 分子不存在时,适配体分子与荧光团分子不结合或结合能力弱,不能显著提高荧光团分子 在合适波长激发光下的荧光;当靶标分子存在时,靶标分子与所述核苷酸序列的结合会促 进适配体分子与荧光团分子的结合,显著提高荧光团分子在合适波长激发光下的荧光,实 现对靶标分子的检测、成像和定量分析。 靶标分子也可以是整个细胞或表达在整个细胞表面的分子。典型的细胞包括但不 限于癌症细胞、细菌细胞,真菌细胞以及正常动物细胞。靶标分子也可以是病毒颗粒。目前 很多的上述靶标分子的适配体被鉴定出来,它们可以被整合本发明中的多价核酸适配体 中。目前已报道的可以结合靶标分子的RNA适配体包括但不限于:T4 RNA聚合酶适配体,HIV 逆转录酶适配体,噬菌体R17衣壳蛋白适配体。 在本发明的一个优选的实施方案中,靶标分子为腺苷(adenosine),其对应的识别 靶标分子的探针序列如SEQ ID NO:21(图10A所示);本发明的一个优选的实施方案中,靶标 分子为GTP,其对应的识别靶标分子的探针序列如SEQ ID NO:22(图10A所示)。 目标核酸分子 “目标核酸分子”又称“靶标核酸分子”是指待检测的核酸分子,可以是细胞内的, 也可以是细胞外的;包括目标RNA分子和目标DNA分子。本发明通过将目标核酸分子与所述 核酸适配体分子连接,通过荧光团分子与核酸适配体分子结合,显著提高荧光团分子在合 适波长激发光下的荧光值,进而实现检测目标核酸分子的含量与分布的目的。 “目标RNA分子”在本发明中包括任意的RNA分子,包括但不限于pre-mRNA,编码细 胞本身或外源表达产物的mRNA,pre-rRNA,rRNA,tRNA,hnRNA,snRNA,miRNA,siRNA,shRNA, sgRNA,crRNA,长链非编码RNA,噬菌体衣壳蛋白MCP识别结合序列MS2 RNA、噬菌体衣壳蛋白 PCP识别结合序列PP7 RNA,λ噬菌体转录终止蛋白N识别结合序列boxB RNA等。靶标RNA可以 融合在本发明RNA适配体分子的5’端或3’端或N19-N20-N21的位置。 “sgRNA”在本发明中指CRISPR/Cas9系统中将tracrRNA和crRNA经改造后形成的单 一的引导RNA(single guide RNA,sgRNA),其5’端20nt左右的序列通过碱基对互补来靶向 DNA位点,促使Cas9蛋白在该位点诱发DNA双链断裂。 核酸适配体的串联体 本发明所述的核酸适配体分子进一步还可包含可以结合多个荧光团分子的串联 体。所述串联体通过适当长度的间隔序列连在一起,串联的Pepper结构的个数可以是2,3, 4,5,6,7,8,9,10或者更多。串联体的形式可以有多种,在本发明一优选的实施方案中,串联 的形式为“串联1”,如图6A所示,优选的核苷酸序列为SEQ ID NO:8、9、10、11或12;其中的 2Pepper-5表示具有2个Pepper-5结构的串联体1;在本发明另一优选的实施方案中,串联的 形式为“串联2”,如图6B所示,优选的核苷酸序列为SEQ ID NO:13、14、15或16;其中的 21 CN 111593052 A 说 明 书 16/39 页 2xPepper-6表示具有2个Pepper-6结构的串联体2;在本发明另一优选的实施方案中,串联 的形式为“串联3”,如图6C所示,优选的核苷酸序列为SEQ ID NO:17、18或19;其中的 2x2Pepper-5表示具有4个Pepper-5结构的串联体3;无论何种形式,串联体之间的间隔序列 可以进行更换。 本发明所述的单体形式的适配体是指仅含有1个Pepper结构的适配体,也就是含2 个茎结构,2个环结构和1个茎环结构(图1A)的适配体。 多聚体形式的适配体是指含有1个以上Pepper结构的适配体,包含但不限于图6所 示的几种串联形式构成的适配体。 适配体-荧光团复合物 本发明的适配体-荧光团复合物包含1个核酸适配体分子以及1个或多个荧光团分 子。在本发明的一
技术实现要素:
中,包含1个核酸分子以及1个荧光团分子的分子复合物为 F30-Pepper-2-III-3、F30-Pepper-2-III-7、F30-Pepper-2-III-6、F30-Pepper-2-III-8、 F30-Pepper-2-III-4、F30-Pepper-2-III-15、F30-Pepper-2-III-18和F30-Pepper-2-III- 21。 在本发明的另一












