技术摘要:
提供一种用于使蛋白质稳定的组合物,该组合物包含含有磷酸盐、组胺酸或其组合的缓冲剂,及稳定剂,该稳定剂不包含氯化钠和/或包含选自由海藻糖、蔗糖及甘露糖醇组成的组的一种或多种;一种稳定化的蛋白质的液体组合物,其包含用于稳定化的组合物及蛋白质;及一种通过使 全部
背景技术:
与一般蛋白质药物相比,融合蛋白药物由于其较大分子量及复杂结构而更可能引 起物理化学不稳定性,且因此需要开发适合调配物。可通过各种条件,诸如pH条件、缓冲剂 类别、蛋白质的浓度、赋形剂及温度等使蛋白质药物的化学及物理稳定性优化。为了开发可 确保融合蛋白的稳定性且维持融合蛋白的药理学活性的调配物,已使用各种手段,诸如缓 冲剂改质、pH优化及稳定剂添加及其类似手段。 另一方面,黄斑变性治疗剂 (阿柏西普(aflibercept))为液体调配物药 物,且具有40mg/mL阿柏西普pH 6.2、10mM磷酸钠、40mM NaCl、5%(w/v)蔗糖及0.03%(w/v) 聚山梨醇酯20的组成。在眼内药物的情况下,对于微可见(sub-visible)粒子的监管标准比 一般生物药剂更严格(参见表1),且因此需要开发考虑微粒态样的调配物。 表1 微可见粒子侦测标准 *基于USP 788,789,光阻测试标准
技术实现要素:
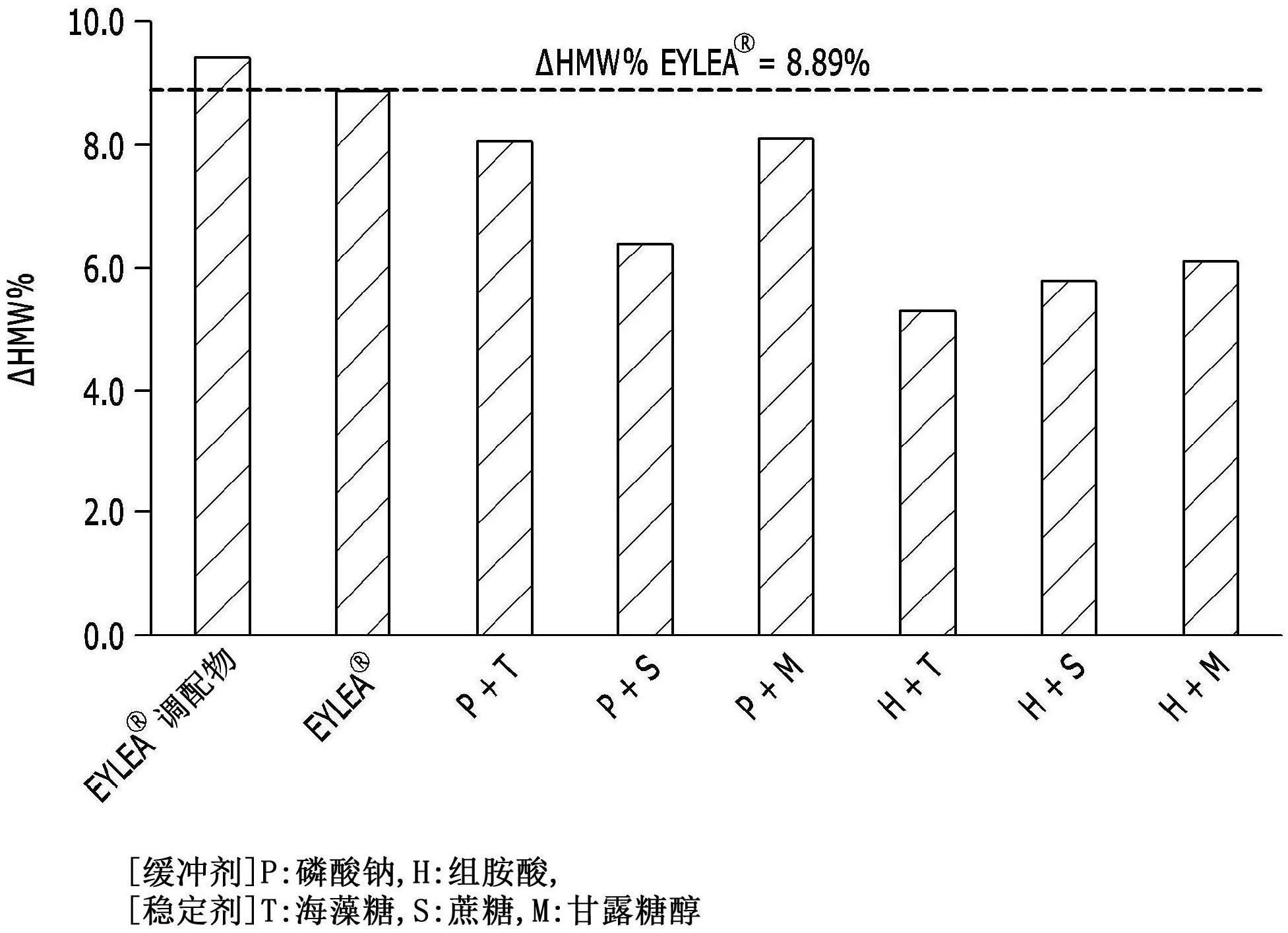
技术问题 相应地,提供一种用于稳定化的组合物,其增强蛋白质药物的稳定性,及包含该用 于稳定化的组合物的蛋白质药物的稳定液体组合物。 一具体实例提供一种用于蛋白质药物稳定化的组合物,其包含 缓冲剂,该缓冲剂包含磷酸钠、组胺酸或其组合,及 稳定剂,该稳定剂不包含氯化钠且/或包含选自由海藻糖、蔗糖、甘露糖醇及其组 4 CN 111556744 A 说 明 书 2/12 页 合组成的组的至少一种。 另一具体实例提供一种液体组合物,该液体组合物包含蛋白质;缓冲剂,该缓冲剂 包含磷酸钠、组胺酸或其组合;及稳定剂,该稳定剂不包含氯化钠且/或包含选自由海藻糖、 蔗糖、甘露糖醇及其组合组成的组的至少一种。 举例而言,液体组合物可包含 (1)5mg/ml至100mg/ml的蛋白质; (2)pH4至8的缓冲剂;及 (3)稳定剂, 其中缓冲剂包含磷酸钠、组胺酸或其组合, 且稳定剂不包含氯化钠且/或包含选自由海藻糖、蔗糖及甘露糖醇组成的组的至 少一种。 液体组合物可进一步包含界面活性剂,例如以总组合物计,呈0.01至3%(w/v)的 量。 另一具体实例提供包含液体组合物的医药组合物。 举例而言,对于液体组合物或医药组合物,蛋白质可为分子量为10至500kDa、10至 400kDa、10至300kDa、10至200kDa或10至150kDa的蛋白质。在一具体实例中,蛋白质可为 VEGF拮抗物,且例如可为选自由以下组成的组的至少一种:阿柏西普(分子量为约97至 115kDa)、贝伐单抗(Bevacizumab)(分子量为约149kDa)、兰尼单抗(Ranibizumab)(分子量 为约48kDa),及其类似物。 当蛋白质为VEGF拮抗物,例如选自由阿柏西普、贝伐单抗、兰尼单抗及其类似物组 成的组的一种或多种类别时,医药组合物可为眼用组合物,且特定的,可为用于玻璃体内给 予的注射剂。 所述液体组合物或医药组合物可用于玻璃体内给予。 又另一具体实例提供一种使蛋白质稳定的方法或一种制备稳定水性液体组合物 的方法,该方法包含将蛋白质与用于稳定化的组合物混合的步骤。 技术解决方案 在本说明书中,提供一种用于稳定化以增强蛋白质稳定性的组合物、一种包含该 组合物的蛋白质的稳定液体组合物、一种用于制备包含蛋白质的稳定水性液体组合物的方 法及一种用于蛋白质稳定化的方法。 一具体实例提供用于蛋白质稳定化的组合物,其包含含有磷酸钠、组胺酸或其组 合的缓冲剂,及稳定剂,该稳定剂不包含氯化钠且/或为选自由海藻糖、蔗糖及甘露糖醇组 成的组的至少一种。 另一具体实例提供一种液体组合物,其包含 (1)蛋白质; (2)缓冲剂,该缓冲剂包含磷酸钠、组胺酸或其组合;及 (3)稳定剂,该稳定剂不包含氯化钠且/或包含选自由海藻糖、蔗糖及甘露糖醇组 成的组的一种或多种类别。 液体组合物中的蛋白质含量可为5mg/ml至100mg/ml、5mg/ml至80mg/ml、5mg/ml至 60mg/ml、5mg/ml至50mg/ml、10mg/ml至100mg/ml、10mg/ml至80mg/ml、10mg/ml至60mg/ml、 5 CN 111556744 A 说 明 书 3/12 页 10mg/ml至50mg/ml、20mg/ml至100mg/ml、20mg/ml至80mg/ml、20mg/ml至60mg/ml、20mg/ml 至50mg/ml、30mg/ml至100mg/ml、30mg/ml至80mg/ml、30mg/ml至60mg/ml或30mg/ml至50mg/ ml,且例如可为5mg/ml、10mg/ml、20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、 80mg/ml、90mg/ml或100mg/ml。 缓冲剂可为pH 4至8,例如pH 5.2至7.5、pH 5.2至7.2、pH 5.2至7、pH 5.2至6.8、 pH 5.2至6.6、pH 5.2至6.4、pH 5.2至6.2、pH 5.5至7.5、pH 5.5至7.2、pH 5.5至7、pH 5.5 至6.8、pH 5.5至6.6、pH 5.5至6.4、pH 5.5至6.2、pH 5.8至7.5、pH 5.8至7.2、pH 5.8至7、 pH 5.8至6.8、pH 5.8至6.6、pH 5.8至6.4、pH 5.8至6.2或pH 6.2的缓冲剂。 缓冲剂可包含选自由以下组成的组的一种或多种类别:磷酸、乙酸、柠檬酸、丁二 酸、该等酸的医药学上可接受的盐(例如,钠盐、钾盐等)及组胺酸。在一具体实例中,缓冲剂 可包含磷酸钠、组胺酸或其组合。可包含以总液体组合物计,浓度为约1mM至约50mM、约1mM 至约40mM、约1mM至约30mM、约1mM至约20mM、约1mM至约15mM、约1mM至约12mM、约5mM至约 50mM、约5mM至约40mM、约5mM至约30mM、约5mM至约20mM、约5mM至约15mM、约5mM至约12mM、约 8mM至约50mM、约8mM至约40mM、约8mM至约30mM、约8mM至约20mM、约8mM至约15mM、约8mM至约 12mM或10mM的缓冲剂。 在一具体实例中,稳定剂可不包含氯化钠。 在其他具体实例中,稳定剂可为选自由海藻糖、蔗糖、甘露糖醇及其组合组成的组 的一或多种类别。举例而言,稳定剂可包含选自由以下组成的组的一或多种类别:1至20% (w/v)、1至15%(w/v)、1至10%(w/v)、5至20%(w/v)、5至15%(w/v)、5至10%(w/v)、7.8至 20%(w/v)、7.8至15%(w/v)、7.8至10%(w/v)、7.8至8.2%(w/v)或8%(w/v)的海藻糖;1至 20%(w/v)、1至15%(w/v)、1至10%(w/v)、5至20%(w/v)、5至15%(w/v)、5至10%(w/v)、 7.8至20%(w/v)、7.8至15%(w/v)、7.8至10%(w/v)、7.8至8.2%(w/v)或8%(w/v)的蔗糖; 及0.5至10%(w/v)、0.5至7.5%(w/v)、0.5至5%(w/v)、1至10%(w/v)、1至7.5%(w/v)、1至 5%(w/v)、3至10%(w/v)、3至7.5%(w/v)、3至5%(w/v)、4至5%(w/v)或4.5%(w/v)的甘露 糖醇。 在一特定具体实例中,当液体组合物包含磷酸钠作为缓冲剂,或包含磷酸盐(例 如,磷酸钠)作为缓冲剂及蔗糖作为稳定剂时,液体组合物可不包含氯化钠。 液体组合物可包含前述含量的蛋白质、缓冲剂及稳定剂,及残余水性介质(例如, 水(纯化水)、生理食盐水溶液、注射用水等)。 在一个具体实例中,液体组合物可进一步包含界面活性剂,例如以总组合物计,呈 0.001至3%(w/v)、0.001至2%(w/v)、0.001至1%(w/v)、0.001至0.5%(w/v)、0.001至 0.1%(w/v)、0.001至0.05%(w/v)、0.01至3%(w/v)、0.01至2%(w/v)、0.01至1%(w/v)、 0.01至0.5%(w/v)、0.01至0.1%(w/v)、0.01至0.05%(w/v)或0.03%(w/v)的量。界面活性 剂可选自可将蛋白质均匀分散于液体组合物介质中的所有医药学上可接受的界面活性剂。 界面活性剂可为非离子界面活性剂;例如,选自由以下组成的组的至少一种:聚山梨醇酯 (例如,聚山梨醇酯20(聚氧乙烯(20)去水山梨糖醇单月桂酸酯)、聚山梨醇酯40(聚氧乙烯 (20)去水山梨糖醇单棕榈酸酯)、聚山梨醇酯60(聚氧乙烯(20)去水山梨糖醇单硬脂酸酯)、 聚山梨醇酯80(聚氧乙烯(20)去水山梨糖醇单油酸酯),其中聚氧乙烯后的数值,即(20)氧 化乙烯基(-(CH2CH2O)-)的总数目;泊洛沙姆(poloxamer)(PEO-PPO-PEO共聚物;PEO:聚(环 6 CN 111556744 A 说 明 书 4/12 页 氧乙烷),PPO:聚(环氧丙烷))、聚乙烯-聚丙二醇、聚氧乙烯化合物(例如,聚氧乙烯-硬脂酸 酯、聚氧乙烯烷基醚(烷基:C1-C30)、聚氧乙烯单月桂基醚、烷基苯基聚氧乙烯共聚物(烷 基:C1-C30),等)、十二烷基硫酸钠(sodium dodecyl sulphate;SDS),及其类似物。举例而 言,界面活性剂可为聚山梨醇酯(例如,聚山梨醇酯20)。 本说明书中所提供的液体组合物可与活体等渗透压。举例而言,液体组合物的渗 透压可为约200mOsm/kg至约400mOsm/kg,例如约250mOsm/kg至约300mOsm/kg。此类渗透压 可由稳定剂调节。 本说明书中所提供的液体组合物的电导率可为约0.1mS/cm或更高,例如约0.1mS/ cm至约10mS/cm、约0.1mS/cm至约7mS/cm、约1mS/cm至约10mS/cm、约1mS/cm至约7mS/cm、约 2.5mS/cm至约10mS/cm、约2.5mS/cm至约7mS/cm、约5mS/cm至约10mS/cm或约5mS/cm至约 7mS/cm。 在本说明书中所提供的液体组合物中,蛋白质可为蛋白质药物,例如分子量为10 至500kDa、10至400kDa、10至300kDa、10至200kDa或10至150kDa的蛋白质(例如,融合蛋白)。 在一具体实例中,蛋白质可为VEGF(血管内皮生长因子;vascular endothelial growth factor)拮抗物,例如VEGF特异性融合蛋白,其中来源于人类VEGF受体1及VEGF受体2的细胞 外域的VEGF结合位点与人类IgG1的Fc区(region)融合。在一特定具体实例中,VEGF特异性 融合蛋白可为一种蛋白质,其中基本上包含人类VEGF受体1(Flt1)的类免疫球蛋白 (immunoglobulin-like;Ig)域(domain)2及人类VEGF受体2(Flt1或Flt4)的Ig域3的区与人 类IgG1的Fc区融合;例如,VEGF特异性融合蛋白可为具有以下SEQ ID NO:1的胺基酸序列的 阿柏西普。 阿柏西普胺基酸序列(SEQ ID NO:1) (二硫桥键:30-79;124-185;246-306;352-410,二聚体:211;214) 融合蛋白可以重组方式或合成方式产生。 本说明书中所提供的液体组合物可在约40℃的高温下稳定维持4周或更多。 术语“稳定性极佳”或“稳定维持”可意谓在储存期间可维持组合物中的蛋白质的 物理、化学及/或生物特性及/或结构(例如,在储存期间,低蛋白质聚合物形成速率、低蛋白 质聚集速率、低蛋白质降解速率及/或低变性速率等)。测量蛋白质稳定性的各种分析技术 是相关技术领域中所熟知的。 举例而言,本说明书中所提供的液体组合物,当蛋白质(抗体)含量为40mg/ml时, 7 CN 111556744 A 说 明 书 5/12 页 在40℃下储存4周期间用习知SEC(粒径排阻层析法;size exclusion chromatography)测 量的蛋白质聚合物形成速率或聚集速率(高分子量%(w/v);High Molecular Weight%(w/ v);HMW%)的变化(储存第四周时的HMW%-第0周(储存开始)时的HMW%)可为约小于9,例如 约8.8或更小或约8.3或更小,但不限于此。 另一具体实例提供包含液体组合物的医药组合物。医药组合物可进一步包含医药 学上可接受的载剂、稀释剂及/或赋形剂。医药学上可接受的载剂为习知使用的载剂,且可 包含选自由以下组成的组的一或多种类别:乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、 阿拉伯胶、磷酸钙、海藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯啶酮、纤维素、水(例 如,纯化水)、生理食盐水溶液、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、 硬脂酸镁、矿物油及其类似物,但不限于此。 液体组合物或医药组合物可经由经口或非经肠途径给予。在非经肠给予(例如,注 射)的情况下,其可通过静脉内给予、皮下给予、肌肉内给予、腹膜内给予、内皮给予、局部给 予、鼻内给予、肺内给予、直肠内给予、瘤内给予、玻璃体内给予等来给予。 在一特定具体实例中,液体组合物或医药组合物可为包含如上文所描述的VEGF拮 抗物的眼用溶液,且在此情况下,可为待给予于眼的玻璃体液中的注射剂。 另一具体实例提供使蛋白质稳定的方法或制备稳定液体组合物的方法,其包含将 蛋白质与前述用于稳定化的组合物混合的步骤。 在一特定具体实例中,提供用于蛋白质稳定化的方法或用于制备稳定水性液体组 合物的方法,其包含将以下混合的步骤: (1)蛋白质; (2)缓冲剂,该缓冲剂包含磷酸钠、组胺酸或其组合; (3)稳定剂,该稳定剂不包含氯化钠且/或包含选自由海藻糖、蔗糖及甘露糖醇组 成的组的一或多种类别;及 (4)视情况选用的界面活性剂。 用于蛋白质稳定化的方法或制备稳定水性液体组合物的方法的各组分的类别及 含量的具体描述与前述相同。 有利影响 本发明通过提供允许诸如融合蛋白的蛋白质稳定维持物理、化学及/或生物功效 持续长时段的用于稳定化的组合物及液体调配物,可对可在蛋白质储存期间出现的聚合物 及/或聚集体产生及片段产生及/或变性成带电变异体进行抑制,从而在长时段内维持蛋白 质的药理效应。 附图说明 图1为展示实施例2中所测量的测试组合物在40℃下4周储存期间4周的HMW%(高 分子量%)变化率(ΔHMW%)的图。 图2为展示基于实施例2中所测量的测试组合物在40℃下4周储存期间4周的Δ HMW%结果,使用Minitab(Minitab,版本17)分析统计显著因子的结果的图。 图3为展示基于实施例3中所测量的测试组合物在40℃下4周储存期间4周的Δ酸 性%结果,使用Minitab分析统计显著因子的结果的图。 8 CN 111556744 A 说 明 书 6/12 页 图4为展示基于实施例4中所测量的测试组合物在40℃下4周储存期间4周的RPA% (相对效力活性;Relative Potency Activity)变化率(ΔRPA%)结果,使用Minitab分析统 计显著因子的结果的图。












