技术摘要:
本发明涉及一种用于生产次丹参酮二烯的重组酵母工程菌,所述工程菌能发酵生产GGPP,通过将不同植物来源的II类二萜合酶基因和I类二萜合酶基因插入到底盘菌中,如将来源于毛喉鞘蕊花的CfTPS1和来源于丹参的SmCPS1二萜合酶进行组合,可获得高产丹参酮二烯的重组工程菌,而 全部
背景技术:
在自然界中,许多二萜类化合物具有重要的药用或生物学活性,但因其结构的复 杂性,很难通过化学合成的手段获得。二萜类化合物按照骨架可以分为克罗烷型 (clerodane)、半日花烷型(labdane)、海松烷型(pimarane)、松香烷型(abietane)以及贝壳 杉烷型(kaurane)二萜1-3。在植物体内,甲羟戊酸(mevalonate,MVA)途径和4-磷酸-2-甲基 赤藓糖(2-C-methyl-D-erythritol-4-phosphate ,MEP)途径产生成异戊烯基焦磷酸 (isopentenyl diphosphate,IPP)及其同分异构体二甲基烯丙基焦磷酸(dimethylallyl diphosphate ,DMAPP),在牻牛儿牻牛儿焦磷酸合酶(geranylgeranyl diphosphate synthase,GGPPS)的催化下,IPP和DMAPP缩合生成二萜类化合物的共同前体物质牻牛儿牻 牛儿焦磷酸((E,E,E)-geranylgeranyl diphosphate,GGPP)(图1-1)4。许多松香烷型二萜 具有重要的药用价值,例如,来源于中药植物雷公藤的雷公藤甲素,具有显著的抗炎、抗肿 瘤、免疫调节等活性,其成药已经处于I和II期临床试验阶段;以及来源于丹参的丹参酮类 成分,具有心血管保护、抗氧化和抗肿瘤等显著药理活性5-8。 尽管二萜类化合物具有广阔的应用前景,但其在天然植物组织中的含量较低,提 取工艺繁琐且效率低下,严重限制了其进一步的开发和应用。相比之下,利用微生物进行天 然产物的异源生产不仅可以保护自然资源还可以实现重要化合物的高效生产,如青蒿素的 前体物质青蒿酸和紫杉醇的重要前体物质紫杉二烯9-10。充足的前体供给对实现二萜类化 合物的途径重构和高效生产至关重要。松香完型二萜广泛存在于药用植物中,是合成多种 二萜化合物的重要中间体,如雷公藤甲素、丹参酮、鼠尾草酸、鼠尾草酚、红砂烷内酯A-D 等11-19。中国专利CN108395997中公开了一种高产二萜类成分的酵母工程菌,并在酿酒酵母 中重构次丹参酮二烯的生物合成途径,将来源于丹参的两条二萜合酶基因(SmCPS1、 SmKSL1)进行模块化途径工程优化,摇瓶发酵水平达到93.63mg/L的水平,在15L的发酵罐中 获得了365mg/L的次丹参酮二烯20;随后,戴住波等人通过质粒过表达参与GGPP生物合成途 径的关键基因,增加前体物质FPP和GGPP的代谢流,使次丹参酮二烯的摇瓶发酵水平达到 61.8mg/L,继而通过发酵罐高密度发酵,产量进一步提高到488mg/L21。然而,这样的产量仍 然达不到工业生产级别。 二萜类化合物的共同前体物质GGPP在含有“DXDD”特征功能域的II类(Class II) 二萜合酶(diterpene synthase,di-TPS)的作用下初始环化为normal构型的柯巴基焦磷酸 (( )-copalyl diphosphate,( )-CPP),随后,在I类(Class I)二萜合酶(含有“DDXXD”特征 功能域)的催化下,进一步环化、重排生成次丹参酮二烯17(附图1)。近年来,越来越多的研究 报导了来源于不同植物的二萜合酶可以生成次丹参酮二烯11-19,22-24,但至今没有研究对这 些二萜合酶生产次丹参酮二烯的效率进行比较。Jia等人收集来源于植物和细菌中的I类和 II类二萜合酶,在大肠杆菌中进行重组表达,并分离鉴定出了13种新的二萜类化合物,并利 用酶的组合效应使部分化合物的产量得到了显著地提高到了15mg/L的水平1。此外,关键酶 的蛋白质修饰,包括融合酶的构建以及转运肽的截短,也是增加萜类化合物产量的有效策 略10,20,25。例如,Jiang等人通组合调控植物来源的香叶醇合酶和酵母自身的异戊烯基转移 4 CN 111548946 A 说 明 书 2/19 页 酶Erg20,将酿酒酵母中香叶醇的产量由痕量提升至524mg/L(摇瓶产量)的国际领先水平26。
技术实现要素:
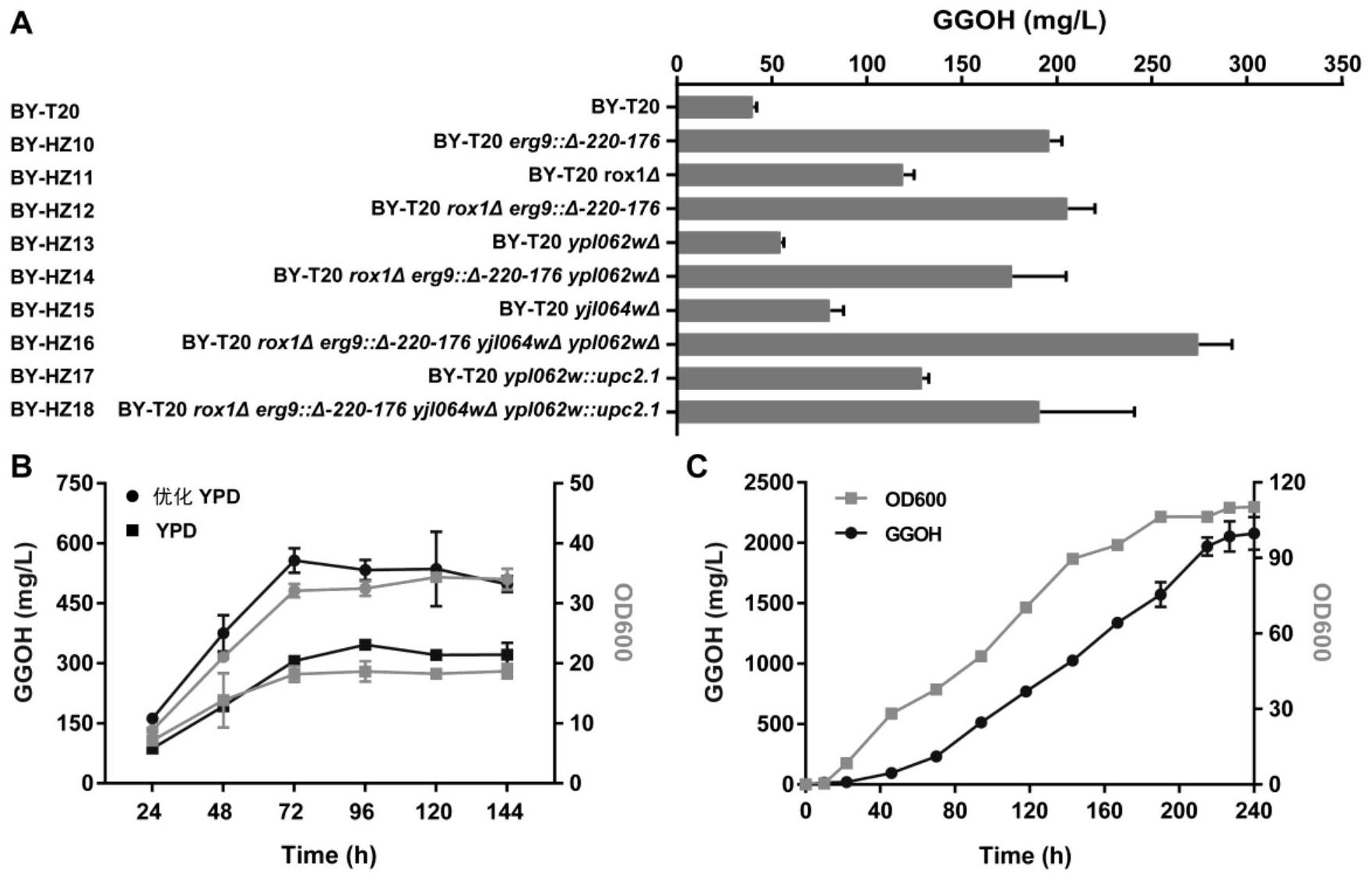
本发明的第一方面,在于提供一种用于生产次丹参酮二烯的重组酵母工程菌,所 述重组酵母工程菌能发酵生产GGPP,采用多策略综合应用,包括(1)底盘菌的优化,提高前 体物质GGPP的供给;(2)多植物来源次丹参酮二烯合酶的组合筛选;和(3)次丹参酮二烯合 成模块的蛋白修饰,以期望获得可进一步提高次丹参酮二烯产量的有效方法。 本发明中,所述的多植物来源的次丹参酮二烯合酶组合,包括不同植物来源的II 类二萜合酶和I类二萜合酶的组合。比如,所述多植物来源的次丹参酮二烯合酶,可以是来 源于7种植物的14条次丹参酮二烯合酶,包含5条II类二萜合酶,8条I类二萜合酶,以及1条 双功能酶(详见表7)。分别是来源于丹参(Salvia miltiorrhiza)的SmCPS1和SmKSL1、雷公 藤(Tripterygium wilfordii)的TwCPS1和TwMS、毛喉鞘蕊花(Coleus forskohlii)的 CfTPS1、CfTPS3和CfTPS4、欧夏至草(Marrubium vulgare)的MvCPS3和MvELS、迷迭香 (Rosmarinus officinalis)的RoCPS1、RoKSL1和RoKSL2、希腊鼠尾草(Salvia fruticosa) 的SfKSL,以及来源于江南卷柏(Selaginella moellendorffii)的双功能次丹参酮二烯合 酶SmoMDS。 将上述II类二萜合酶的编码基因与I类二萜合酶编码基因进行随机组合,转化到 可产GGPP的底盘菌中。 具体地,本发明所述重组酵母菌,首先其能够发酵生产GGPP,并在所述重组酵母工 程菌中,新插入了包含如下基因: (1)选自II类二萜合酶基因SmCPS1、TwCPS1、CfCPS1、MvCPS3或RoCPS1中的任意一 种;以及 (2)选自I类二萜合酶基因SmKSL1、TwMS、CfTPS3、CfTPS4、MvELS、RoKSL1、RoKSL2或 SfKSL中的任意一种。 本发明中,对于相同字母,或表示酶或表示酶的编码基因,在于字母斜体应用的不 同,一个示例性的如SmCPS1,当用SmCPS1时,表示酶;而当用SmCPS1,表示该酶的编码基因。 本发明技术人员意外发现,II类萜类合酶CfTPS1与I类萜类合酶组合时,次丹参酮 二烯产量高于其他II类萜类合酶,因此本发明一种优选的方式是:所述重组酵母工程菌中 包含: (1)II类二萜合酶基因优选为CfCPS1,以及 (2)选自I类二萜合酶基因SmKSL1、TwMS、CfTPS3、CfTPS4、MvELS、RoKSL1、RoKSL2或 SfKSL中的任意一种。 另一方面,当I类萜类合酶SmKSL1与II类萜类合酶组合时,次丹参酮二烯的产量普 遍高于其他I类萜类合酶,因此本发明另一种优选的方式是:所述重组酵母工程菌中包含: (1)选自II类二萜合酶基因SmCPS1、TwCPS1、CfCPS1、MvCPS3或RoCPS1中的任意一 种;以及 (2)I类二萜合酶基因SmKSL1。 更为优选的一种方式是,本发明所重组酵母工程菌,II类二萜合酶基因为CfCPS1, I类二萜合酶基因为SmKSL1。 5 CN 111548946 A 说 明 书 3/19 页 本发明中,一个具体的实施方式可以是:如可以将I类二萜合酶基因和II类二萜合 酶基因分别构建至pESC系列真核表达载体中,如构建至pESC-LEU的pGAL1和pGAL10启动子 下游。表达载体也可以是其它,比如pYX212以及pESC系列其他筛选标记载体。 本发明的第二方面,进一步地,将获得的生产次丹参酮二烯高产模块CfTPS1与 SmKSL1进行融合蛋白的构建,以柔性肽“GGGS”编码序列将CfTPS1与SmKSL1两条基因首尾相 连成为融合蛋白模块(去掉前面基因的终止密码子),技术人员意外发现,当以SmKSL1- CfTPS1方式融合时,次丹参酮二烯的产量比未融合的方式,提高了约1.81倍,而以CfTPS1- SmKSL方式融合时,反而使次丹参酮二烯产量下降了近30%。因此,在本发明一个优选的实 施方案中,所述II类二萜合酶基因CfTPS1,和所述I类二萜合酶基因SmKSL1,通过SmKSL1- CfTPS1融合方式,插入到可产GGPP的酵母菌中,得到生产次丹参酮二烯的重组酵母工程菌。 在本发明的第三方面,基于融合蛋白SmKSL1-CfTPS1高产模块基础上,对融合基因 进行了进一步修饰。将融合蛋白SmKSL1-CfTPS1的SmKSL1 N端的叶绿体转运肽(M2-C47)截 掉,形成截短的融合蛋白(下文称tSmKSL1-CfTPS1,其编码基因为tSmKSL1-CfTPS1),发现截 短体融合蛋白的次丹参酮二烯产量得到了明显的提高,达到了截短前的约1.75倍。然而,在 截短了SmKSL1 N端的叶绿体转运肽(M2-C47)基础上,进一步将CfTPS1的N端转运肽(M2- N81)截掉,次丹参酮二烯产量反而出现显著下调,仅有约融合蛋白SmKSL1-CfTPS1的58%, 但仍比未融合之前高,为未融合之前的约1.8倍。因此,本发明的一个优选实施方案中,将在 融合蛋白SmKSL1-CfTPS1的SmKSL1 N端的叶绿体转运肽(M2-C47)截掉而得到的截短融合蛋 白tSmKSL1-CfTPS1编码基因tSmKSL1-CfTPS1,插入到可产GGPP的酵母菌中,得到生产次丹 参酮二烯的重组酵母工程菌。一个具体的实施方案,可以是将融合酶基因构建到表达载体 的pGAL10启动子下游。 本发明第四方面,本发明通过进一步改造生产次丹参酮二烯的重组酵母工程菌, 以提高重组酵母酵母中前体物质GGPP的供给,结合优化后的次丹参酮二烯合酶基因模块, 以期获得在酵母菌中次丹参酮二烯产量的进一步提高。 优选地,本发明所述重组酵母工程菌,在酵母菌过表达融合酶基因BTS1/ERG20、牻 牛儿牻牛儿焦磷酸合酶基因SaGGPS和HMG-CoA还原酶基因催化活性域tHMG1。 在一个更为优选的实施方案中,所述重组酵母菌,在过表达BTS1/ERG20、SaGGPS和 tHMG1基础上,进一步敲除了ROX1基因、YJL064w基因、YPL062w基因或ERG9启动子激活域 (ERG9p)中的任意一种或多种,如单独敲除酵母菌中的ROX1基因,或单独敲除酵母菌中的 YJL064w基因,或单独敲除YPL062w基因,或单独敲除ERG9p,也可以是敲除这些基因的组合, 如敲除ROX1基因和ERG9p,或敲除ROX1基因和YPL062w基因,或敲除ROX1基因和YJL064w基 因,或敲除ERG9p和YPL062w基因,或敲除ERG9p和YJL064w基因,或敲除ROX1基因、ERG9p和 YJL064w基因,或敲除ROX1基因、ERG9p和YPL062w基因,或敲除ERG9p、YPL062w和YJL064w基 因,或4个基因都敲除调。 中国专利CN108395997A公开了通过CRISPR/Cas9基因编辑技术改造酿酒酵母工程 菌,增强二萜类化合物的生产能力,筛选得到高产GGPP的底盘菌,具体筛选方案包括: (1)对BY4742菌进行改造,得到BY-T20底盘菌: BY-T20酿酒酵母工程菌由BY4742改造而来,基因型为MATαtrp1Δ0leu2Δ0ura3Δ 0,trp1::HIS3-PPGK1-BTS1/ERG20-TADH1-PTDH3-SaGGPS-TTPI1-PTEF1-tHMG1-TCYC1,前期已针对二 6 CN 111548946 A 说 明 书 4/19 页 萜途径进行了相应的改造(构建方法还可参考文献:Zhubo Dai ,Beibei Wang ,Xueli Zhang,et al.Scientific Reorts.2014(4):3698│DOI:10.1038/srep03698,1-6),在其基 因组中过表达了HMGR、ERG20、BTSI和嗜酸热硫化叶菌的SaGGPS等增强GGPP代谢流的基因, 但是并未对MVA途径起到抑制作用的基因进行改造。 (2)对BY-T20底盘菌的进一步改造,以获得GGPP积累能力更强的底盘菌:改造策略 如下:①弱化FPP向三萜和甾醇途径转移的第一个关键基因ERG9的表达,敲除其启动子序列 的诱导型顺式元件UAS;②敲除抑制甾醇途径上基因表达的转录因子编码基因ROX1;③敲除 基因YPL062w和YJL064w,以提高MVA途径代谢流。将改造完成的菌株发酵,并检测二萜化合 物共同前体物质GGPP的含量,筛选得到最优工程菌。 上述的改造方案均在中国专利CN108395997A(公开日2018.08.14)已有详细说明, 在此将该专利全文引用到本发明中,可以通过CN108395997A实施例1至实施例10的技术方 案,筛选底盘菌,底盘菌菌株信息如表3。 本发明中,所用的酵母工程菌,可以是来源于GEN.PK系酿酒酵母菌或BY系酿酒酵 母菌,优选为BY系酿酒酵母,如可以是BY4741酿酒酵母、BY4742酿酒酵母或BY-T20酿酒酵 母。 本发明的第五方面,提供了一种生产次丹参酮二烯的方法,所述方法包括: 将生产次丹参酮二烯的重组酵母工程菌接种到培养基中,进行发酵,提取分离发 酵后的菌液,得到目标产物次丹参酮二烯,其中,所述重组酵母工程菌能发酵生产GGPP,并 且所述重组酵母工程菌包含: (1)选自II类二萜合酶基因SmCPS1、TwCPS1、CfCPS1、MvCPS3或RoCPS1中的任意一 种;以及 (2)选自I类二萜合酶基因SmKSL1、TwMS、CfTPS3、CfTPS4、MvELS、RoKSL1、RoKSL2或 SfKSL中的任意一种; 一种优选的II类二萜合酶基因与I类二萜合酶基因的组合方式是: (1)II类二萜合酶基因优选为CfCPS1,以及 (2)选自I类二萜合酶基因SmKSL1、TwMS、CfTPS3、CfTPS4、MvELS、RoKSL1、RoKSL2或 SfKSL中的任意一种。 一种优选的I类二萜合酶基因与II类二萜合酶基因的组合方式是: (1)选自II类二萜合酶基因SmCPS1、TwCPS1、CfCPS1、MvCPS3或RoCPS1中的任意一 种;以及 (2)I类二萜合酶基因SmKSL1。 更为优选的一种方式是,本发明所重组酵母工程菌,II类二萜合酶基因为CfCPS1, I类二萜合酶基因为SmKSL1。 本发明中,所述生产次丹参酮二烯的方法,其中所述II类二萜合酶基因CfCPS1与I 类二萜合酶基因SmKSL1与通过融合方式插入到重组酵母菌中,优选的是以SmKSL1-CfTPS1 方式融合。 在一优选的实施方案中,所述生产次丹参酮二烯的方法,其中融合基因SmKSL1- CfCPS1在SmKSL1的N端进行了截短,比如截短SmKSL1的N端叶绿体转运肽S2-C47编码基因。 本发明生产次丹参酮二烯的方法,所述重组酵母菌经进一步改造以提高重组酵母 7 CN 111548946 A 说 明 书 5/19 页 中前体物质GGPP的供给,并结合优化后的次丹参酮二烯合酶基因模块,以期获得在酵母菌 中次丹参酮二烯产量的进一步提高,比如在酵母菌过表达融合酶基因BTS1/ERG20、牻牛儿 牻牛儿焦磷酸合酶基因SaGGPS和HMG-CoA还原酶基因催化活性域tHMG1。在此基础上,进一 步敲除了ROX1基因、YJL064w基因、YPL062w基因或ERG9启动子激活域(ERG9p)中的任意一种 或多种,得到优化的底盘菌。 本发明生产次丹参酮二烯的方法,所述重组酵母菌,可以是来源于GEN.PK系酿酒 酵母菌或BY系酿酒酵母菌,优选为BY系酿酒酵母,如可以是BY4741酿酒酵母、BY4742酿酒酵 母或BY-T20酿酒酵母。 附图说明 图1为酿酒酵母中GGPP和次丹参酮二烯的生物合成途径示意图。 图2为改造的底盘菌菌株中GGOH产量图,其中A为不同基因型菌株中GGOH的产量;B 为不同培养基发酵BY-HZ16菌株的GGOH产量;C为BY-HZ16菌株GGOH的高密度发酵结果。 图3为次丹参酮二烯真核表达载体的构建示意图,其中MCS(Multiple cloning site)表示多克隆位点。 图4为丹参酮二烯的GC-MS定性检测图,其中A为次丹参酮二烯的气象色谱检测结 果;B为次丹参酮二烯的质谱鉴定结果。 图5为不同来源二萜合酶组合的次丹参酮二烯产量比较图。 图6为二萜合酶CfTPS1及SmKSL1的不同融合方式对次丹参酮二烯产量的影响,其 中A为不同融合方式在菌株中次丹参酮二烯的产量比较,B为两种不同融合方式蛋白的结构 模拟。 图7为不同蛋白截短对次丹参酮二烯产量的影响,其中A为表达蛋白截短变体的菌 株中次丹参酮二烯的产量;B为对蛋白截短体表达菌株的产物进行GC-MS定性分析;C为不同 菌株中二萜类产物产量的比较分析。 图8为BY-HZ70菌株的高密度发酵的次丹参酮二烯的产量。 图9为不同表达模块在不同底盘菌中次丹参酮二烯产量比较,不同菌中,不同模块 对次丹参酮二烯表达产量的影响趋势基本一致。












